ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
НОВОСИБИРСКОЙ ОБЛАСТИ
«БАРАБИНСКИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Рассмотрено на заседании ЦМК
Протокол № ____от________________
Председатель_____________________
(Ф.И.О)
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ТЕОРЕТИЧЕСКОГО ЗАНЯТИЯ ДЛЯ ПРЕПОДАВАТЕЛЯ
Специальность 34.02.01 Сестринское дело (с базовой подготовкой)
Дисциплина «Химия»
Раздел 2. Общая химия
Тема 2.2. Характеристика состояния электрона в атоме
Разработчик: преподаватель химии Дъячук Людмила Владимировна
2018
Содержание
Методический лист …………………………………………………………..4 Интегративные связи…………………………………………………………6
Примерная хронокарта занятия……………………………………………...7
Исходный материал………………………………………………………….10
Контроль знаний по предыдущей теме…………………………………….14
Задания для закрепления и систематизации знаний……………………….16
Предварительный контроль знаний………………………………………...17
Задание для самостоятельной внеаудиторной работы студентов………...18
Список использованных источников……………………………………….19
Выписка из рабочей программы
дисциплины «Химия»
для специальности 34.02.01 Сестринское дело (с базовой подготовкой)
| Тема 2.2. Характеристика состояния электрона в атоме | Содержание учебного материала | 2 |
|
| Квантовые числа. Дуализм электрона. Электронная конфигурация атома. Принцип Паули. Основные правила заполнения электронами энергетических уровней. Организация собственной деятельности при составлении электронных формул атомов элементов. | 1,2 |
| Лабораторные работы | - |
|
| Практические занятия | - |
| Контрольные работы | - |
| Самостоятельная работа обучающихся: работа с конспектом лекции, [2, §3] | 0,5 |
МЕТОДИЧЕСКИЙ ЛИСТ
Тип занятия – комбинированный урок
Вид занятия – лекция, объяснение с демонстрацией наглядных пособий, выполнения упражнений.
Продолжительность – 90 мин.
ЦЕЛИ ЗАНЯТИЯ
1. Учебные цели:
- сформировать знания о квантовых числах, дуализме электрона, электронной конфигурации атома, принципе Паули, основных правилах заполнения электронами энергетических уровней. Сформировать умения составления электронных формул атомов химических элементов.
2. Развивающие цели:
- развивать логическое мышление, внимание, память, умение осуществлять самостоятельный поиск информации в различных источниках, организовывать собственную деятельность, необходимую для выполнения профессиональных задач.
3. Воспитательные цели:
- создавать содержательные и организационные условия для развития самостоятельности в добывании студентами знаний, скорости восприятия и переработки информации, культуры речи, воспитании настойчивости в достижении цели, формирование способности организовывать собственную деятельность при составлении электронных формул атомов химических элементов.
Методы обучения – объяснительно-иллюстративный, репродуктивный, частично – поисковый.
Место проведения занятия – кабинет биологии, анатомии и генетики
человека с основами медицинской генетики.
МОТИВАЦИЯ
На протяжении нескольких тысячелетий человечество волновал вопрос: «Как устроен мир?». Древние греки все существующее пытались свести к четырем «стихиям» (вода, воздух, земля, и огонь), с тех пор немало различных картин мира сменили друг друга. Но вера в то, что физический мир можно построить из небольшого количества некоторых первичных частей, или «элементов», никогда не покидали людей. Уже, в V в. до н.э., Демокрит пришел к идее о существовании атома. «Из маленьких атомов мира творенье, из атомов – букв состоят сочинения».
Составляя свою периодическую систему, Д.И. Менделеев расположил все элементы по возрастанию массового числа, но есть противоречия, которые он объяснить не мог. Например: Ar и K, Te и I. Почему? Нужна была новая теория, которая бы объяснила эти противоречия. На помощь пришла физика.
При химических реакциях атомы не исчезают и не возникают вновь. Они просто переходят из одних веществ в другие, но их ядра остаются неизменными. Однако свойства атомов одного и того же элемента сильно различаются в зависимости от того, в каком веществе они находятся. Так, свойства атомов серы в простом веществе отличаются от свойств атомов этого же элемента в серной кислоте. Свойства атомов натрия в простом веществе и в любой его соли также совершенно различны.
Если состав ядер данного элемента не меняется при химических реакциях, очевидно, что все изменения, происшедшие с данным атомом, являются результатом изменения его электронного строения.
При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. Поэтому состоянию электронов в атоме и структуре электронных оболочек уделяется большое внимание при изучении химии.
Знание основополагающих законов данной учебной дисциплины позволит медицинскому работнику организовывать собственную деятельность для эффективного выполнения профессиональных задач.
Интегративные связи

ПРИМЕРНАЯ ХРОНОКАРТА ЗАНЯТИЯ
| п/№ | Наименование этапа | Время | Цель этапа | Деятельность | Оснащение |
| преподавателя | студентов |
| -1- | -2- | -3- | -4- | -5- | -6- | -7- |
-
| Организационный этап | 2 мин. | Организация начала занятия, подготовка рабочего места студентов | Отмечает отсутствующих студентов в журнале | Староста называет отсутствующих студентов. Студенты приводят в соответствие внешний вид, готовят рабочие места. | Журнал, тетради
|
-
| Контроль знаний по предыдущей теме | 20 мин. | Оценка уровня сформированности знаний по теме «Атом – сложная частица. Электронные оболочки атомов» | Инструктирует и проводит контроль | Индивидуальный опрос | Приложение 1 контрольные вопросы, упражнение |
-
| Мотивационный этап | 2 мин. | Развитие интереса к новой теме | Объясняет студентам важность изучения данной темы | Слушают, задают вопросы | Методическая разработка теоретического занятия |
-
| Цели занятия | 2 мин | Установка приоритетов при изучении темы | Озвучивает цели занятия | Слушают, записывают в тетрадь новую тему | Методическая разработка теоретического занятия, презентация |
-
| Изложение исходной информации | 40 мин. | Формирование знаний о квантовых числах, дуализме электрона, электронной конфигурации атома, принципе Паули, основных правилах заполнения электронами энергетических уровней. Формирование умения составлять электронные формулы атомов химических элементов. | Излагает новый материал | Слушают, записывают |
|
-
| Выполнение заданий для закрепления знаний | 12мин. | Закрепление знаний, формирование умений составлять электронные формулы атомов химических элементов. Развитие логического мышления, внимания, памяти, умения осуществлять самостоятельный поиск информации в различных источниках, организовывать собственную деятельность, необходимую для выполнения профессиональных задач при составлении электронных формул атомов химических элементов.
| Инструктирует и контролирует выполнение заданий, обсуждает правильность ответов | Выполняют задания, слушают правильные ответы, после выполнения, вносят коррективы | Приложение 2 Задания для закрепления знаний |
-
| Предварительный контроль новых знаний и проверка | 10 мин. | Оценка эффективности занятия и выявление недостатков в новых знаниях, развитие самостоятельности в добывании студентами знаний, скорости восприятия и переработки информации, культуры речи, воспитание настойчивости в достижении цели. | Инструктирует и проводит контроль | Выполняют задания | Приложение 3
|
-
| Подведение итогов занятия | 1 мин | Развитие эмоциональной устойчивости, дисциплинированности | Оценивает работу группы в целом. Объявляет оценки, мотивирует студентов, выделяет наиболее подготовленных | Слушают, участвуют в обсуждении, задают вопросы | Журнал |
| 9. | Задание для самостоятельной внеаудиторной работы студентов | 1 мин. | Формирование и закрепление знаний, развитие умения работать с конспектом, с учебной литературой. | Дает задание для самостоятельной внеаудиторной работы студентов, инструктирует | Записывают задание | Приложение 4 |
Исходный материал
План
1. Квантовые числа
2. Принцип Паули
3. Разновидности электронных орбиталей
4. Последовательность заполнения электронных орбиталей в атоме
Квантовые числа
Полная характеристика состояния электрона в атоме включает его энергию, размер, форму, пространственную ориентацию орбитали и направление собственного вращения электрона.
Все эти характеристики зависят от набора квантовых чисел:
1) Главное квантовое число (n) – характеризует общий запас энергии электрона или его энергетический уровень.
2) Орбитальное квантовое число (l) - число принимает значение 0(s), 1 (p), 2 (d), 3 (f). Орбитальное квантовое число зависит от главного квантового числа и принимает ряд значений, максимальное из которых равно n – 1. Орбитальное квантовое число определяет количество движения электрона и форму орбиталей. S- сферическая, p – форма восьмёрки, d – лист клевера. Формой орбитали определяется пространственное расположение атомов в молекулах.
3) Магнитное квантовое число – ml. Магнитное квантовое число связано с орбитальным, оно определяет пространственную ориентацию орбиталей. Ориентация s – орбитали однозначна, поэтому s – подуровни состоят из одной орбитали. Гантелеобразные p – орбитали ориентируются вдоль взаимоперпендекулярных направлений, таким образом, существуют 3 ориентированные орбитали.
4) Спиновое квантовое число – ms. Это проекция спина. Спин – вращение электрона вокруг собственной оси по часовой или против часовой стрелки.
Принцип Паули
Швейцарский физик Паули в 1925 году установил, что в атоме на одной орбитали может находиться не более 2 электронов, имеющих противоположные спины.
Все электроны в атоме находятся в разных состояниях, т.е. характеризуются разными наборами четырёх квантовых чисел.
Если на орбитали находится один электрон, он называется неспаренным, если два, то это уже спаренные электроны, т.е. электроны с противоположными спинами.
Разновидности электронных орбиталей
S – орбиталь имеет сферическую форму, электрон атома водорода располагается на этой орбитали и неспарен. Его электронная формула или электронная конфигурация – 1S1. Для гелия электронная формула – 1S2.
P – орбиталь имеет форму гантели, 3 p – орбитали расположены в атоме взаимно перпендикулярно, каждый энергетический уровень, начиная со второго имеет 3 p- орбитали. У элементов второго периода сначала заполняется 2s орбиталь, а затем – 2p орбиталь.
s
p
d
f
Последовательность заполнения электронных орбиталей в атоме
Для того чтобы понять нагромождение уровней, подуровней, орбиталей, сравним атом с многоэтажным домом, дом разделён на этажи (уровни), а в квартирах может быть одна комната (орбиталь), три, пять или семь. Все этажи – уровни пронумерованы. Самому нижнему этажу (уровню, ближайшему к ядру) присвоен № 1, следующему – 2 и т.д. Причём, чем выше нужно подниматься по лестнице, тем больше энергии нужно затратить (аналогично, чем дальше уровень от ядра, тем выше его энергия). Однако, если вы внимательно посмотрите, то увидите, что «некоторые» квартиры расположены как-будто между этажами, так 3dподуровень оказался между 4s и 4p подуровнями.
Последовательность заполнения электронами энергетических уровней следующая:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 7s
Часто строение электронных оболочек изображают с помощью квантовых ячеек (графические формулы).
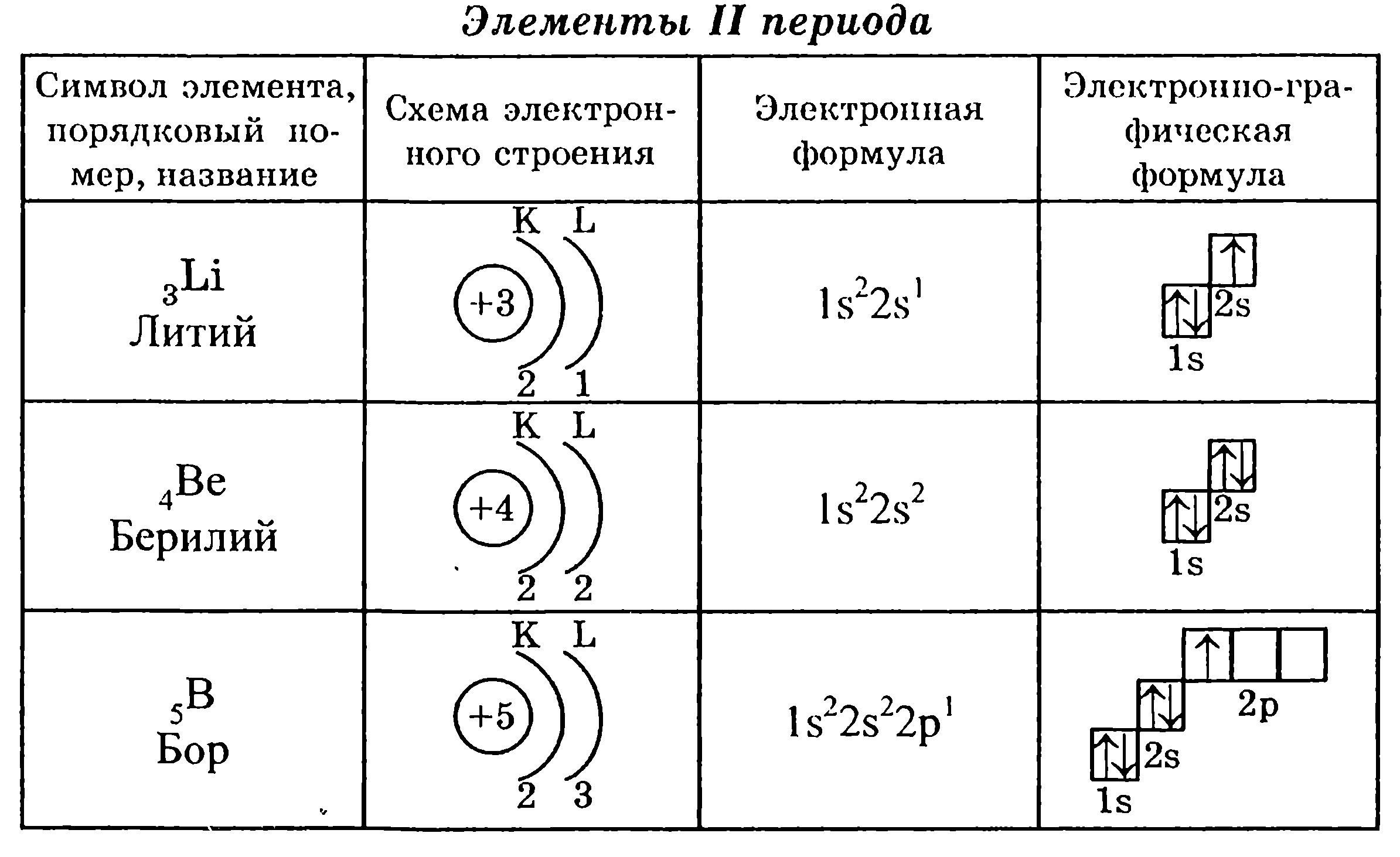
Элементы IV периода

Самостоятельное заполнение и составление электронных формул и графических схем для элементов третьего и четвёртого периода.
s- элементы – у этих элементов электронами заполняется s- подуровень, это элементы главных подгрупп 1 и 2 групп.
P – элементы – у них заполняется электронами p – подуровни, это элементы главных подгрупп 3-7 групп.
d – элементы, у этих элементов заполняется d – подуровень – элементы побочных подгрупп 1-8 групп.
f- элементы, к ним относятся лантаноиды и актиноиды.
Приложение 1
Контроль знаний по предыдущей теме
1. Что такое атом? Что такое химический элемент? Как развивалась теория строения атомов?
2. Что представляет собой планетарная модель строения атома? Постулаты Бора
3. Что такое орбиталь? Энергетический уровень? Как определить число энергетических уровней в атоме данного химического элемента?
4. Главное квантовое число. Как определить максимальное число электронов на данном энергетическом уровне?
5. Что такое изотопы? Количеством каких частиц, отличаются изотопы друг от друга?
Критерии оценки за устный опрос (контрольные вопросы):
Оценка "5" ставится, если обучающийся: показывает глубокое и полное знание и понимание материала; полное понимание сущности рассматриваемых понятий, явлений и закономерностей, теорий, взаимосвязей; умеет составить полный и правильный ответ; правильно и обстоятельно отвечает на дополнительные вопросы; допускает не более одного недочёта, который легко исправляет.
Оценка "4" ставится, если обучающийся: показывает знание всего изученного материала; даёт полный и правильный ответ; допускает незначительные ошибки и недочёты; небольшие неточности в формулировке понятий; материал излагает в логической последовательности, допуская негрубую ошибку или два недочёта, которые может исправить.
Оценка "3" ставится, если обучающийся: излагает материал фрагментарно; не всегда последовательно, допускает ошибки при формулировке выводов, ошибки при определении понятий; отвечает неполно на вопросы преподавателя.
Оценка "2" ставится, если обучающийся: не раскрывает основное содержание материала; не делает выводов и обобщений; допускает более двух грубых ошибок, которые не может исправить даже при помощи преподавателя.
Задание 1.
Вставьте пропущенные слова:
Атом элемента имеет порядковый номер 13 и массовое число 27. Общее число электронов у него равно ……….., суммарный заряд которых ……. . Число валентных электронов ………. Количество протонов в ядре равно ………, суммарный заряд которых ……. Количество нейтронов …. Схема электронного строения и графическая формула этого элемента:
Эталон ответа:
Атом элемента имеет порядковый номер 13 и массовое число 27. Общее число электронов у него равно 13, суммарный заряд которых - 13 . Число валентных электронов - 3. Количество протонов в ядре равно 13, суммарный заряд которых - +13. Количество нейтронов - 14. Схема электронного строения и графическая формула этого элемента:
1S22S22P63S23P1
Al +13 )2)8)3
Критерии оценок за задание 1:
Оценка «5» ставится, если правильно выполнено всё задание
Оценка «4» ставится, если допущены 1-2 ошибки
Оценка «3» ставится, если допущено 3-4 ошибки
Оценка «2» ставится, если правильно выполнено менее половины задания.
Задание 2.
Атом элемента имеет на шесть электронов больше, чем ион магния. Назовите элемент, составьте электронную формулу его атома или иона.
Эталон ответа:
В атоме магния 12 электронов, в ионе Mg2+ - 10 электронов, следовательно, у определяемого элемента должно быть 16 электронов. Это – S.
Электронная формула атома серы – 1S22S22P63S23P4
Критерии оценок за задание 2:
Оценка «5» ставится, если правильно выполнено всё задание
Оценка «4» ставится, если допущена одна несущественная ошибка
Оценка «3» ставится, если неправильно составлена электронная формула
Оценка «2» ставится, если правильно выполнено менее половины задания.
Приложение 2
Задания для закрепления знаний по теме «Характеристика состояния электрона в атоме»
Задание 1.
Ответьте на вопросы устно:
1) Какие квантовые числа используют для характеристики состояния электрона в атоме? (главное квантовое число, орбитальное квантовое число, магнитное квантовое число, спиновое квантовое число).
2) За какие характеристики отвечает главное квантовое число? (определяет энергию электрона и размер электронного облака).
3) Что характеризует орбитальное квантовое число? (различные энергетические состояния электронов данного уровня, определяет форму электронного облака).
4) Что характеризует магнитное квантовое число? (положение электронного облака в пространстве относительно внешнего магнитного или электрического поля).
5) Что характеризует спиновое квантовое число? (вращение электрона вокруг собственной оси).
6) Как определяется принадлежность химического элемента к тому или иному электронному семейству? (Это зависит от того, какой подуровень атома заполняется электронами последним).
За каждый правильный ответ – 1 балл.
Задание 2.
Выполните письменно задание:
Составьте электронные формулы атомов следующих химических элементов:
1) железа;
2) ниобия;
3) золота.
Эталон ответов:
1) 1S22S22P63S23P63d64S2;
2) 1S22S22P63S23P63d104S24P64d45S1;
3) 1S22S22P63S23P63d104S24P64d105S25P66S14f145d10
За каждый правильный ответ – 1 балл.
Приложение 3
Предварительный контроль новых знаний
Задание 1.
Выберите правильный ответ:
1. Электронная формула внешнего энергетического уровня атома алюминия:
А) 3S23P3
Б) 3S23d1
B) 3S23P1
Г) 3P13d2
2. По четыре электрона находится на внешнем электронном слое атомов элементов:
А) C,N,O
Б) Mg, Al, Si
B) C, Si, P
Г) C, Si, Ge
3. Электронная конфигурация 1S22S22P63S23P63d5 соответствует частице:В
А) Fe0
Б) Fe2+
B) Fe3+
Г) Fe6+
4. Химическому элементу Э, образующему оксид ЭО, соответствует схема распределения электронов по слоям:
А) 2, 8, 1
Б) 2, 8, 6
В) 2, 8, 2
Г) 2, 5
Дополните предложения:
5. Максимально возможное число электронов на энергетическом уровне определяется формулой:……………………………….
6.Максимальное число электронов, которые могут занимать 3d орбиталь равно ……………………
7. Элементы, валентность которых в соединениях равна I:…………………
8. Только отрицательное значение степени окисления имеет атом элемента в соединениях:……………….
Эталон ответов:
1. В;
2. Г;
3. В;
4. В;
5. 2N2;
6. 10;
7. элементы первой группы главной подгруппы;
8. фтора.
За каждый правильный ответ – 1 балл.
Критерии оценок за работу по новой теме
Оценка «5»: обучающийся набирает 8 баллов (1балл за каждый правильный ответ)
Оценка «4»: обучающийся набирает 5-7 баллов
Оценка «3»: обучающийся набирает 3-4 балла (ставится по желанию)
Приложение 4
Задание для самостоятельной внеаудиторной работы студентов
Изучите конспект лекции, выполните письменно задание: [2, §3, упр. 1в,д]
Эталоны ответов:
Zr
Распределение электронов по электронным слоям: 2, 8, 18, 10, 2
Электронная формула: 1S22S22P63S23P63d104S24P64d25S2
Hf
Распределение электронов по электронным слоям: 2, 8, 18, 32, 10, 2
Электронная формула: 1S22S22P63S23P63d104S24P64d104f145S25P65d26S2
Критерии оценок
Оценка «5» ставится, если правильно выполнено всё задание
Оценка «4» ставится, если допущена 1 ошибка
Оценка «3» ставится, если правильно выполнено только одно задание
Оценка «2» ставится, если задание не выполнено
Список использованных источников
1. Габриелян, О. С. Химия. 11 класс: Настольная книга для учителя [Текст]: пособие для учителя / О. С. Габриелян, И. Г. Остроумов; под ред. Н. В. Губина. – М.: Дрофа, 2010. – 480 с.
2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с.
3. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с.
4. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с.


























