
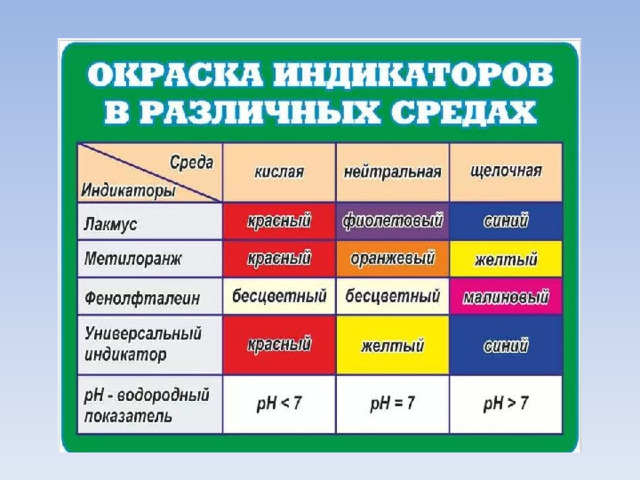
ИНДИКАТОРЫ



Диссоциация кислот:
H 2 SO 4 → 2H + + SO 4 2-
HCl → H + + Cl -
HNO 3 → H + + NO 3 2-

Диссоциация оснований :
NaOH → Na + + OH - ;
Ca(OH) 2 → Ca 2+ + 2OH - ;


Диссоциация растворимых солей:
NaCI Na + + CI -
AI 2 (SO 4 ) 3 2AI 3+ + 3SO 4 2-

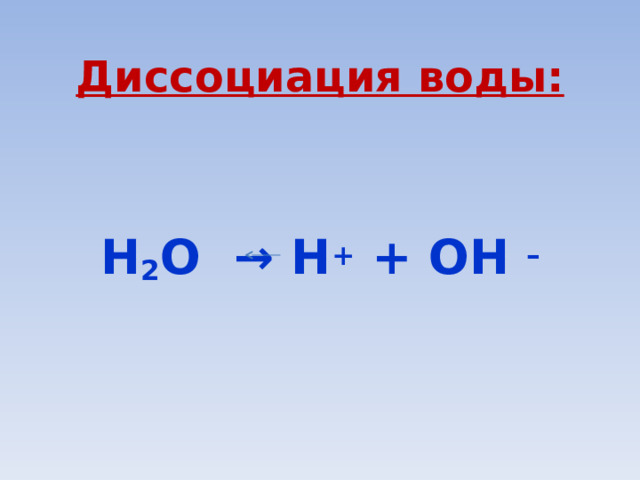
Диссоциация воды:
Н 2 О → Н + + ОН –

Понятие «гидролиз солей»
ГИДРОЛИЗ – от греческих слов гидро – вода, лизис – разложение.
Гидролиз – это реакция обмена между солями и водой, приводящая к образованию слабого электролита.
Если кислота слабая, то образуется кислая соль, если основание – основная соль, и происходит изменение среды раствора.

4 типа солей:
соль, образованная
- сильной кислотой и слабым основанием ( AL Cl 3 );
- сильным основанием и слабой кислотой (Na 2 S);
- сильным основанием и сильной кислотой (NaCl);
- слабым основанием и слабой кислотой ( СН3СОО NH4 ).

 7 щелочная среда [ OH ] - [ H ] + Слабый проигрывает! или Кто сильнее того и больше! " width="640"
7 щелочная среда [ OH ] - [ H ] + Слабый проигрывает! или Кто сильнее того и больше! " width="640"
Схема гидролиза карбоната натрия
N a 2 CO3
Говорят: гидролиз протекает по аниону
Na OH
сильное основание
H 2 CO 3
слабая кислота
pH 7
щелочная среда
[ OH ] -
[ H ] +
Слабый проигрывает! или Кто сильнее того и больше!

 7 щелочная среда Одним из продуктов данной обменной реакции является кислая соль. ВЫВОД: Раствор соли образованной слабой кислотой и сильным основанием гидролизуется по аниону. В растворе в свободном виде осталися ионы гидроксильных групп (ОН - ), следовательно среда раство ра щелочная. " width="640"
7 щелочная среда Одним из продуктов данной обменной реакции является кислая соль. ВЫВОД: Раствор соли образованной слабой кислотой и сильным основанием гидролизуется по аниону. В растворе в свободном виде осталися ионы гидроксильных групп (ОН - ), следовательно среда раство ра щелочная. " width="640"
Уравнение гидролиза карбоната натрия
CO 3 2- + HOH → HCO 3 - + OH - Na 2 C O 3 + H 2 O → NaHCO 3 + NaOH
pH 7
щелочная среда
Одним из продуктов данной обменной реакции является кислая соль.
ВЫВОД: Раствор соли образованной слабой кислотой и сильным основанием гидролизуется по аниону. В растворе в свободном виде осталися ионы гидроксильных групп (ОН - ), следовательно среда раство ра щелочная.
![Схема гидролиза хлорида алюминия А lCl 3 Говорят: гидролиз протекает по катиону Al ( OH ) 3 слабое основание HCl сильная кислота pH кислая среда [ OH ] - [ H ] + Слабый проигрывает! или Кто сильнее того и больше!](https://fsd.multiurok.ru/html/2024/02/24/s_65d9cbc1e0c68/img16.jpg)
Схема гидролиза хлорида алюминия
А lCl 3
Говорят: гидролиз протекает по катиону
Al ( OH ) 3
слабое основание
HCl
сильная кислота
pH
кислая среда
[ OH ] -
[ H ] +
Слабый проигрывает! или Кто сильнее того и больше!

Уравнение гидролиза хлорида алюминия
А l 3+ + HOH → AlOH ++ + H + AlCl 3 + H 2 O → AlOHCl2 + HCl
pH
кислая среда
Одним из продуктов данной обменной реакции 1и 2 ступени является основная соль.
ВЫВОД: Раствор соли образованной слабым основанием и сильной кислотой гидролизуется по катиону. В растворе в свободном виде остался ион водорода (Н + ), следовательно среда раствора кислая.
![Схема гидролиза сульфида берилия BeS Говорят: гидролиз протекает как по катиону так и по аниону Be ( OH ) 2 слабое основание H 2 S слабая кислота pH ≈ 7 нейтральная среда [ OH ] - [ H ] + ≈ Слабый проигрывает! или Кто сильнее того и больше!](https://fsd.multiurok.ru/html/2024/02/24/s_65d9cbc1e0c68/img18.jpg)
Схема гидролиза сульфида берилия
BeS
Говорят: гидролиз протекает как по катиону так и по аниону
Be ( OH ) 2
слабое основание
H 2 S
слабая кислота
pH ≈ 7
нейтральная среда
[ OH ] -
[ H ] +
≈
Слабый проигрывает! или Кто сильнее того и больше!

Уравнение гидролиза сульфида берилия
BeS + HOH → ОН - + S-- BeS + 2 H 2 O → B е (OH) 2 ↓ + H 2 S↑
pH ≈ 7
нейтральная среда
Одним из продуктов данной обменной реакции является слабая кислота и слабое основание.
ВЫВОД: Раствор соли образованной слабым основанием и слабой кислотой гидролизуется по катиону и аниону. Среда раствора оказывается близкой к нейтральной (слабокислая или слабощелочная).
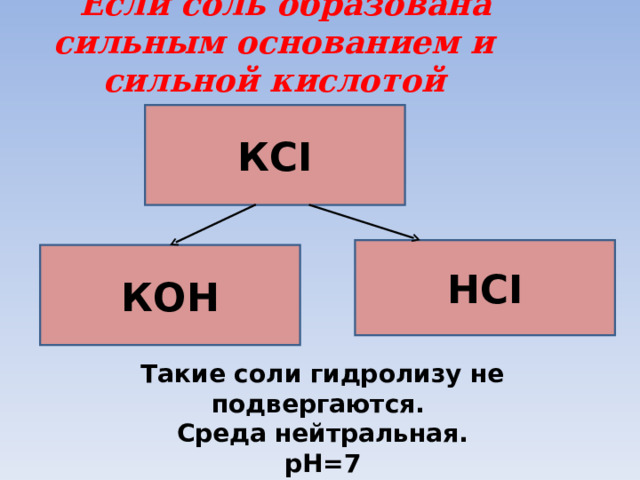
Если соль образована сильным основанием и сильной кислотой
К CI
HCI
К OH
Такие соли гидролизу не подвергаются.
Среда нейтральная.
р H=7
 7 " width="640"
7 " width="640"
2. Если соль образована сильным основанием и слабой кислотой
Na 2 CO 3
H 2 CO 3
NaOH
Гидролиз идет по аниону с образованием кислой соли. Гидролиз обратимый.
Среда щелочная.
р H7
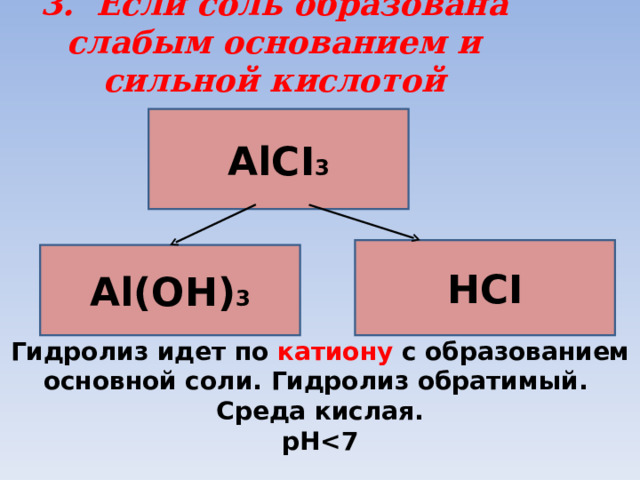
3. Если соль образована слабым основанием и сильной кислотой
А lCI 3
HCI
Al(OH) 3
Гидролиз идет по катиону с образованием основной соли. Гидролиз обратимый.
Среда кислая.
р H
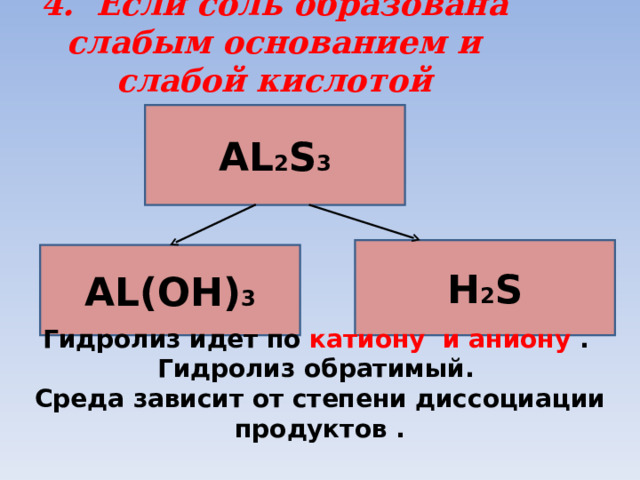
4. Если соль образована слабым основанием и слабой кислотой
AL 2 S 3
H 2 S
AL(OH) 3
Гидролиз идет по катиону и аниону .
Гидролиз обратимый.
Среда зависит от степени диссоциации продуктов .

LiCI
Соль образована…
Гидролиз идет по…
Универсальная индикаторная бумажка стала…
Среда…
р H …

K 2 CO 3
Соль образована…
Гидролиз идет по…
Универсальная индикаторная бумажка стала…
Среда…
р H …


AL 2 (SO 4 ) 3
Соль образована…
Гидролиз идет по…
Универсальная индикаторная бумажка стала…
Среда…
р H …

CuCI 2
Соль образована…
Гидролиз идет по…
Универсальная индикаторная бумажка стала…
Среда…
р H …

FeCI 3
Соль образована…
Гидролиз идет по…
Универсальная индикаторная бумажка стала…
Среда…
р H …

Zn(NO 3 ) 2
Соль образована…
Гидролиз идет по…
Универсальная индикаторная бумажка стала…
Среда…
р H …

K 2 SO 4
Соль образована…
Гидролиз идет по…
Универсальная индикаторная бумажка стала…
Среда…
р H …


- Гидролиз – процесс взаимодействия ионов соли с ионами воды и изменением рН среды.
- Обязательное условие гидролиза – образование слабого электролита
- Гидролиз идет по слабому иону;
- Сильный ион определяет среду.
- Гидролиз – процесс обратимый.

Домашнее задание
1.Установите соответствие между названием соли и отношением её к гидролизу .
НАЗВАНИЕ СОЛИ
ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) сульфид цезия
Б) сульфат алюминия
В) карбонат натрия
Г) ацетат аммония
1.Гидролизуется по катиону
2.Гидролизуется по аниону
3.Гидролизуется по катиону и аниону
4.Не гидролизуется

2. Напишите уравнения гидролиза солей:



















 7 щелочная среда [ OH ] - [ H ] + Слабый проигрывает! или Кто сильнее того и больше! " width="640"
7 щелочная среда [ OH ] - [ H ] + Слабый проигрывает! или Кто сильнее того и больше! " width="640"

 7 щелочная среда Одним из продуктов данной обменной реакции является кислая соль. ВЫВОД: Раствор соли образованной слабой кислотой и сильным основанием гидролизуется по аниону. В растворе в свободном виде осталися ионы гидроксильных групп (ОН - ), следовательно среда раство ра щелочная. " width="640"
7 щелочная среда Одним из продуктов данной обменной реакции является кислая соль. ВЫВОД: Раствор соли образованной слабой кислотой и сильным основанием гидролизуется по аниону. В растворе в свободном виде осталися ионы гидроксильных групп (ОН - ), следовательно среда раство ра щелочная. " width="640"
![Схема гидролиза хлорида алюминия А lCl 3 Говорят: гидролиз протекает по катиону Al ( OH ) 3 слабое основание HCl сильная кислота pH кислая среда [ OH ] - [ H ] + Слабый проигрывает! или Кто сильнее того и больше!](https://fsd.multiurok.ru/html/2024/02/24/s_65d9cbc1e0c68/img16.jpg)

![Схема гидролиза сульфида берилия BeS Говорят: гидролиз протекает как по катиону так и по аниону Be ( OH ) 2 слабое основание H 2 S слабая кислота pH ≈ 7 нейтральная среда [ OH ] - [ H ] + ≈ Слабый проигрывает! или Кто сильнее того и больше!](https://fsd.multiurok.ru/html/2024/02/24/s_65d9cbc1e0c68/img18.jpg)


 7 " width="640"
7 " width="640"































