В чем горят дрова и газ, Фосфор, водород, алмаз? Дышит чем любой из нас Каждый миг и каждый час? Без чего мертва природа? Правильно, без …
Кислород и его свойства
Токтосунова Замира
Бектурсуновна
Ответ: Кислорода

Кислород его характеристика, получение и свойства
«Кислород – это та ось, вокруг которой вращается химия»
А.Берцелиус

План урока
1. Нахождение кислорода в природе.
2. История открытия кислорода.
3. Кислород, как элемент
4. Свойства кислорода.
5. Получение кислорода в лаборатории.
6. Применение кислорода.
7. Домашнее задание
8. Закрепление

1. Нахождение кислорода в природе.
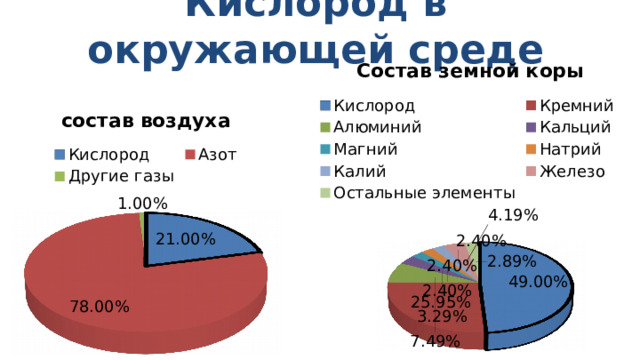
Кислород в окружающей среде
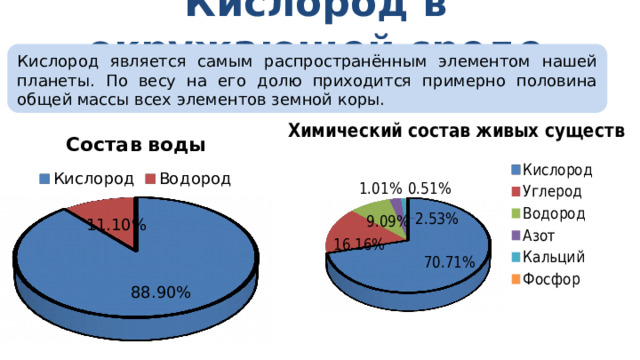
Кислород в окружающей среде
Кислород является самым распространённым элементом нашей планеты. По весу на его долю приходится примерно половина общей массы всех элементов земной коры.

2. История открытия кислорода.
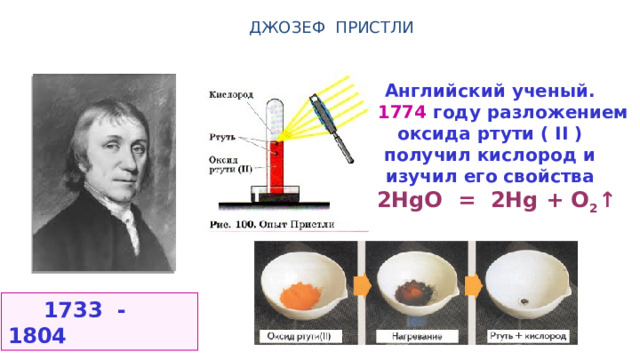
ДЖОЗЕФ ПРИСТЛИ
Английский ученый.
В 1774 году разложением
oксида ртути ( II )
получил кислород и
изучил его свойства
2HgO = 2Hg + O 2 ↑
1733 - 1804

КАРЛ ВИЛЬГЕЛЬМ ШЕЕЛЕ
Шведский ученый.
В 1771 году провел опыты
по разложению
оксида ртути ( II ),
изучил свойства
образующегося газа.
Однако результаты
его исследований
были опубликованы
лишь в 1777 году.
хлор
глицерин
1742 - 1786
барий
молибден

АНТУАН ЛОРАН ЛАВУАЗЬЕ
С целью проверки опытов Шееле и Пристли
в 1774 году получил кислород, установил его
природу и изучил его способность соединяться
с фосфором и серой при горении и металлами
при обжиге. Изучил состав атмосферного воздуха.
Создал кислородную теорию горения. Совместно с
Ж. Менье установил сложный состав воды и получил
воду из кислорода и водорода.
2H 2 + O 2 = 2H 2 O
Лавуазье показал, что процесс дыхания
подобен процессу горения.
1743 - 1794
Название кислороду Oxygenium дал А. Лавуазье

КОРНЕЛИУС ДРЕББЕЛЬ
Голландский алхимик и технолог. Получил кислород примерно за 150 лет до Пристли и Шееле при нагревании нитрата калия:
2КNO 3 = 2KNO 2 + O 2 ↑ Его открытие было засекречено, т.к. использование полученного газа предполагалось для дыхания людей на подводных лодках
1572 - 1633

3. Кислород, как элемент

Кислород как элемент.
- В какой группе, подгруппе и периоде находится элемент кислород?
- Какой он имеет порядковый номер?
- Какая атомная масса кислорода?
- Какая валентность?
- В состав каких
- веществ и соединений
- входит кислород?

Кислород как элемент.
- Элемент кислород находится в VI группе, главной подгруппе, II периоде,
- порядковый номер №8,
- Ar = 16.
- валентность II
- Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов- до 65% по массе.

4. Свойства кислорода.

Физические свойства
Газ - без цвета, вкуса и запаха; в 100V H 2 O растворяется 3V O 2 (н.у.);
t кип= -183 С; t пл = -219 C; d по воздуху = 1,1.
При давлении 760 мм. рт.ст. и температуре
– 183 С кислород сжижается
3
Сосуд Дьюара
2

Химические свойства
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
Со сложными веществами
4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2
2H 2 S + 3O 2 2SO 2 + 2H 2 O
CH 4 + 2O 2 CO 2 + 2H 2 O
С неметаллами
C + O 2 CO 2
S + O 2 SO 2
2H 2 + O 2 2H 2 O
С металлами
2Mg + O 2 2MgO
2Cu + O 2 – t 2CuO

5. Получение кислорода в лаборатории.

Способы получения кислорода
1) разложение перманганата калия
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑

2) разложение пероксида водорода
2H 2 O 2 = 2H 2 O + O 2 ↑
Катализаторы – это вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются.
Пример: MnO 2 ускоряет процесс разложения перекиси водорода.

3) разложение хлората калия
2KClO 3 = 2KCl + 3O 2 ↑
4) разложение оксида ртути (II)
2HgO = 2Hg + O 2 ↑
5)электролиз воды
2H 2 O = 2H 2 ↑ + O 2 ↑
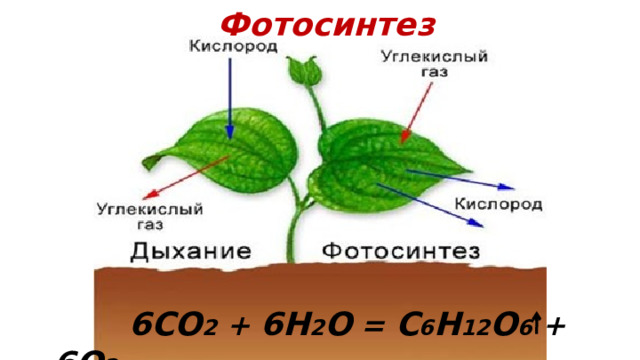
Фотосинтез
6CO 2 + 6H 2 O = C 6 H 12 O 6 + 6O 2
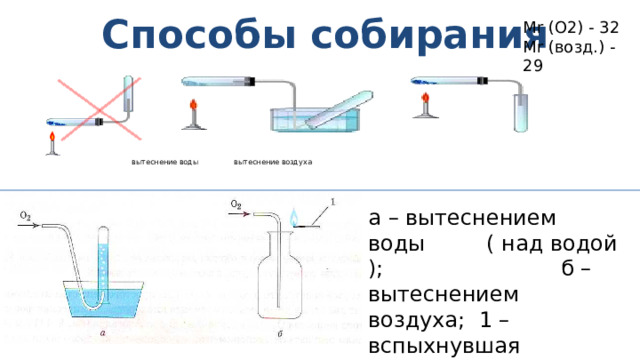
Способы собирания
Mr (O2) - 32
Mr (возд.) - 29
вытеснение воды вытеснение воздуха
а – вытеснением воды ( над водой ); б – вытеснением воздуха; 1 – вспыхнувшая тлеющая лучина

6. Применение кислорода.

Применение кислорода:
- Находит широкое применение в медицине и промышленности.
- При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
- Кислородом в баллонах снабжают подводные лодки.
- Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
- Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.

7. Домашнее задание

Домашнее задание

8. Закрепление
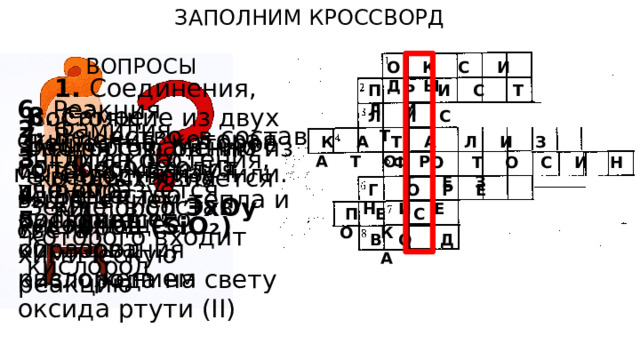
ЗАПОЛНИМ КРОССВОРД
ВОПРОСЫ
О К С И Д Ы
П Р И С Т Л И
6. Реакция окисления, которая сопровождается выделением тепла и света
8. Самое распространенное вещество на Земле, в состав которого входит кислород
Л И С Т
2. Фамилия английского ученого, получившего кислород разложением оксида ртути (II)
7. Вещество, в состав которого входит элемент кислород (SiO 2 )
Вещество, которое мы сегодня изучили.
1. Соединения, состоящие из двух элементов, одним из которых является кислород ЭхОу
К А Т А Л И З А Т О Р
3. Орган растения, где образуется кислород
Ф О Т О С И Н Т Е З
4. Вещество, ускоряющее химическую реакцию
Г О Р Е Н И Е
5. Процесс образования кислорода на свету
П Е С О К
В О Д А

СПАСИБО ЗА ВНИМАНИЕ!!!





















































