Просмотр содержимого документа
«Химия 8-класс Тема: Химиялык байланыштар»
Тема: Химиялык байланыштар
ХИМИЯ 8-класс

Терс электрдүүлүк
- Электрондук катмарлары толуп бүтө элек бардык атомдор химиялык байланышты түзүүгө жөндөмдүү болушат. Эгерде байланышты түзүүгө ар башка химиялык элементтин атомдору катышса, анда электрондук жуптар биринин атомун көздөй жылышкан абалда болот. Химиялык байланышты түзүүдө, электрондук жупту өзүнө тартып алуу касиети–терс электрлүүлүк деп аталат.
- Терс электрлүүлүк – бул атомдордун башка элементтин электрондорун өзүнө тартып алуу жөндөмдүүлүгү. Атомдордун терс электрлүүлүгү жөнүндөгү түшүнүк америкалык химик Л. Полинг тарабынан киргизилген.


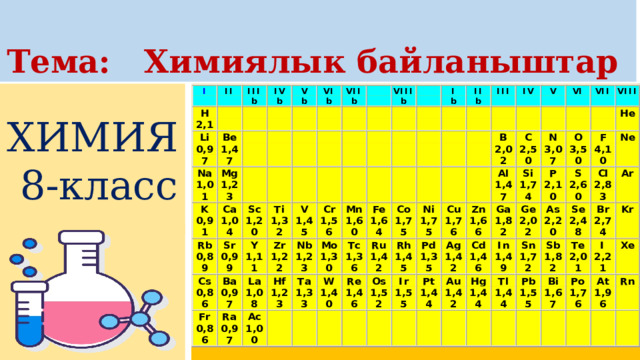
Химиялык элементтердин терс электрдүүлүгү
- Атомдун түзүлүш теориясы боюнча, элементтердин металлдарга жана металл эместерге таандык болушу, химиялык реакция убагында алардын атомунун электрондорун берүү же кошуп алуу жөндөмдүүлүгүнө жараша болот.
- Атомдору электрондорун оңой берген элементтер күчтүү металлдык касиетке ээ болушат. Алардын терс электрлүүлүгү төмөн болот (χ ≤ 1). Ал эми атомдору электрондорду өзүнө оңой кошуп алган элементтердин металл эместик касиети күчтүү болот.

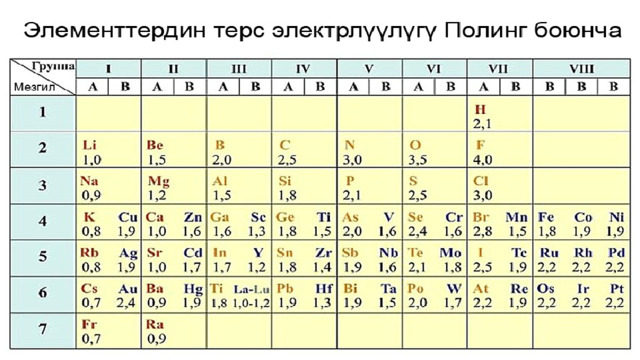
Терс электрдүүлүк шкаласы
- Группаларда электрондук катмарлардын санынын өсүшү менен элементтердин терс электрлүүлүгү төмөндөйт, б.а.жогортон төмөн карай элементтердин терс электрлүүлүгү азаят. Эң жогорку терс электрлүүлүктү көрсөткөн элемент фтор (F) , ал эми төмөнкү терс электрлүүлүктү көрсөткөн элемент франций (Fr) болуп саналат. Мезгилдерде жана группаларда жайгашкан элементтердин терс электрлүүлүгүн салыштыруу үчүн терс электрлүүлүктүн шкаласы пайдаланылат.
- Эң кеңири таралган шкаланы белгилүү америкалык химик Л. Полинг түзгөн.

Химиялык байланыштар
- 1. Сырткы энергетикалык денгээли 8 электронго чейин толгон атомдун абалы туруктуу болуп саналат (Н, Не – 2 электронго чейин) .
- 2. VIII A группанын атомдорунун сырткы деңгээли толуп бүткөн.
- 3.

Химиялык байланыштын түзүлүшү
- Химиялык байланыштын түзүлүшүнүн негизги себеби – байланыштын пайда болуу процессинде сыртка энергиянын бөлүнүп чыгышы жана пайда болгон молекуланын туруктуулугунун жогорулашы болуп саналат.
- 4. Атомдогу электрон менен ядронун аракеттенүүсү энергиянын азайышына алып келет, энергия канчалык аз болсо, атом ошончолук туруктуу болот.
- 5. Атомдордун сырткы деңгээлдерин толтуруунун жолдору:
- жалпы электрондук жуптардын пайда болушу
- электрондорду берүү же кошуп алуу

Кычкылдануу даражасы
- Атомдо электрондук жуптардын жылышынын натыйжасында,электрондорду өзүнө тартып алган атом бир аз терс заряддалат, ал эми электрондорун берген атом бир аз оң зарядга ээ болот.
- Эгерде электрондордун жылышын толук өттү деп эсептесек, анда электронун берген атом оң заряддалат, ал эми электронду тартып алган атом терс зарядга ээ болот.
- Бир элементтин башка элементтин атомуна берген же кошуп алган электрондордун саны окистенүү даражасы деп аталат.
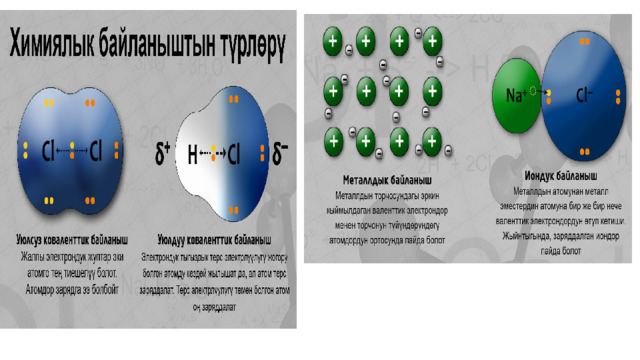
 1,7) байланыш – иондордун ортосундагы электростатикалык тартылуу күчүнөн келип чыккан байланыш (иондорду берүү же кошуп алуу). 2. Коваленттик (∆ЭО = 0 – 1,7) байланыш – жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш. уюлсуз (∆ЭО = 0) – бир түрдүү металл эместердин атомдорунун ортосундагы байланыш. уюлдуу (0 – ар түрдүү металл эместердин атомдорунун ортосундагы байланыш. 3. Металлдык байланыш – металлдын кристаллдык торчосунун түйүндөрүндө жайгашкан атомдорду же иондорду валенттик электрондор байланыштырып турат. Бул металлдардагы жана куймалардагы байланыш (болжол менен коваленттик байланыштан 3–4 эсе начар). 4. Суутектик байланыш – суутектин атому менен терс электрлүүлүгү күчтүү болгон элементтин ортосундагы байланыш F, O, N, Cl. (болжол менен коваленттик байланыштан 15–20 эсе начар). молекула ичиндеги байланыш – белоктор, полипептиддер молекула ортосундагы байланыш – суу, спирт, аммиак, аминокислоталар ж.б. " width="640"
1,7) байланыш – иондордун ортосундагы электростатикалык тартылуу күчүнөн келип чыккан байланыш (иондорду берүү же кошуп алуу). 2. Коваленттик (∆ЭО = 0 – 1,7) байланыш – жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш. уюлсуз (∆ЭО = 0) – бир түрдүү металл эместердин атомдорунун ортосундагы байланыш. уюлдуу (0 – ар түрдүү металл эместердин атомдорунун ортосундагы байланыш. 3. Металлдык байланыш – металлдын кристаллдык торчосунун түйүндөрүндө жайгашкан атомдорду же иондорду валенттик электрондор байланыштырып турат. Бул металлдардагы жана куймалардагы байланыш (болжол менен коваленттик байланыштан 3–4 эсе начар). 4. Суутектик байланыш – суутектин атому менен терс электрлүүлүгү күчтүү болгон элементтин ортосундагы байланыш F, O, N, Cl. (болжол менен коваленттик байланыштан 15–20 эсе начар). молекула ичиндеги байланыш – белоктор, полипептиддер молекула ортосундагы байланыш – суу, спирт, аммиак, аминокислоталар ж.б. " width="640"
1. Иондук (∆ЭО 1,7) байланыш – иондордун ортосундагы электростатикалык тартылуу күчүнөн келип чыккан байланыш (иондорду берүү же кошуп алуу).
2. Коваленттик (∆ЭО = 0 – 1,7) байланыш – жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш.
уюлсуз (∆ЭО = 0) – бир түрдүү металл эместердин атомдорунун ортосундагы байланыш.
уюлдуу (0 – ар түрдүү металл эместердин атомдорунун ортосундагы байланыш.
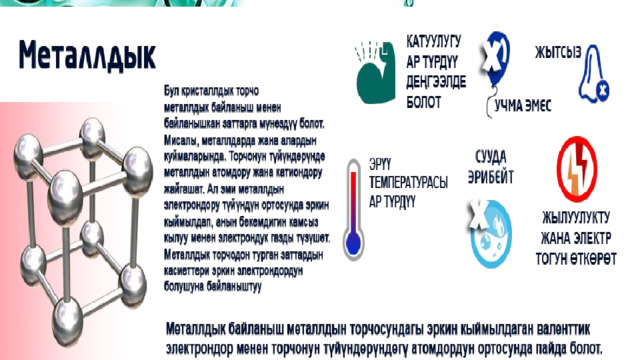
3. Металлдык байланыш – металлдын кристаллдык торчосунун түйүндөрүндө жайгашкан атомдорду же иондорду валенттик электрондор байланыштырып турат. Бул металлдардагы жана куймалардагы байланыш (болжол менен коваленттик байланыштан 3–4 эсе начар).
4. Суутектик байланыш – суутектин атому менен терс электрлүүлүгү күчтүү болгон элементтин ортосундагы байланыш F, O, N, Cl. (болжол менен коваленттик байланыштан 15–20 эсе начар).
молекула ичиндеги байланыш – белоктор, полипептиддер
молекула ортосундагы байланыш – суу, спирт, аммиак, аминокислоталар ж.б.


Коваленттик байланыш
- Электрондордун өз ара аракеттенүүсүнүн натыйжасында, жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш.
- Эгерде бири–бири менен аракеттенишкен атомдордун терс электрдүүлүгү бирдей болсо, анда жалпы электрондук жуп эки атом үчүн бирдей болот, б.а. эки атомго тең бирдей аралыкта жайгашат. Мындай коваленттик байланыш уюлсуз коваленттик байланыш деп аталат. Ал жөнөкөй заттарда – металл эместердин ортосунда түзүлɵт. М: H 2 , О 2 , N 2 , Cl 2 , P 4 , O 3 болот.:
- Терс электрдүүлүгү ар түрдүү болгон атомдор өз ара аракеттенгенде, мисалы, суутек менен хлор, жалпы электрондук жуп терс электлүүлүгү жогору болгон атомду карай жылышат, б.а. хлорду көздөй жылат.
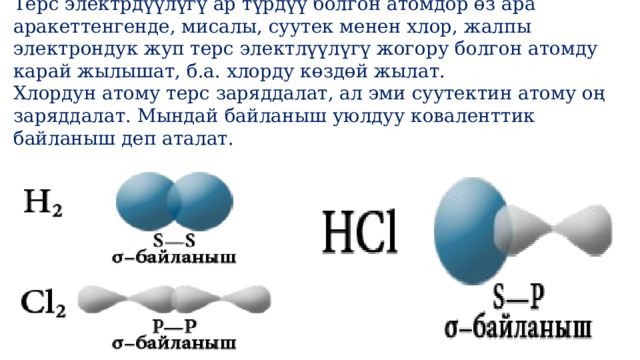
Терс электрдүүлүгү ар түрдүү болгон атомдор өз ара аракеттенгенде, мисалы, суутек менен хлор, жалпы электрондук жуп терс электлүүлүгү жогору болгон атомду карай жылышат, б.а. хлорду көздөй жылат.
Хлордун атому терс заряддалат, ал эми суутектин атому оң заряддалат. Мындай байланыш уюлдуу коваленттик байланыш деп аталат.
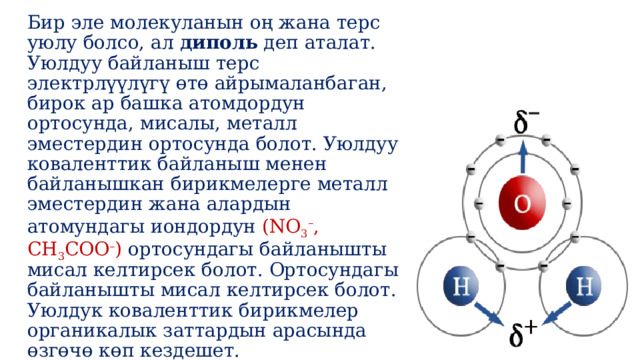
Бир эле молекуланын оң жана терс уюлу болсо, ал диполь деп аталат. Уюлдуу байланыш терс электрлүүлүгү өтө айрымаланбаган, бирок ар башка атомдордун ортосунда, мисалы, металл эместердин ортосунда болот. Уюлдуу коваленттик байланыш менен байланышкан бирикмелерге металл эместердин жана алардын атомундагы иондордун (NO 3 – , CH 3 COO – ) ортосундагы байланышты мисал келтирсек болот. Ортосундагы байланышты мисал келтирсек болот. Уюлдук коваленттик бирикмелер органикалык заттардын арасында өзгөчө көп кездешет.

Коваленттик байланыштын мүнөздөмөсү
- Байланыштын уюлдуулугу
- Атомдук орбиталдардын капталышынын түрлөрү жана байланыштын көп түрдүүлүгү
- Байланыштардын багыттуулугу жана каныккандыгы Коваленттик байланыштын уюлдуулугу ядронун айланасында электрондук булуттардын жылышуусун көрсөтүп турат.
- Байланыштын уюлдуулугу байланышты түзгөн атомдордун түрлөрүнөн жана заряддардан көз каранды болот. Органикалык химияда заряддар +δ жана –δ деп белгиленет. Байланыштын уюлдуулугу реакциянын жүрүшү үчүн чон мааниге ээ болот.
- Уюлсуз байланыш терс электрлүүлүгү бирдей болго атомдордун ортосунда түзүлөт. Уюлсуз байланышкан молекулаларда байланыштын диполу нөлгө барабар болот. Бири–бири менен байланышкан элементтердин терс электрлүүлүктөрү кескин айрымаланса, байланыш ошончо уюлдуу болот.
 2), өтө айрымалангандыктан, бирөө экинчисинин электрондорун өзүнө тартып алып, терс заряддалган ионго (анион) , экинчиси электронун берип, оң заряддалган ионго (катион) айланат. Иондук байланыш (ИБ) – терс электрлүүлүгү кескин айрымаланган атомдордун, металлдардын жана металл эместердин атомдорунун ортосунда түзүлөт. (Мисалы, NaCl, K 2 O, LiF) " width="640"
2), өтө айрымалангандыктан, бирөө экинчисинин электрондорун өзүнө тартып алып, терс заряддалган ионго (анион) , экинчиси электронун берип, оң заряддалган ионго (катион) айланат. Иондук байланыш (ИБ) – терс электрлүүлүгү кескин айрымаланган атомдордун, металлдардын жана металл эместердин атомдорунун ортосунда түзүлөт. (Мисалы, NaCl, K 2 O, LiF) " width="640"
Иондук байланыш
- Байланышка катышкан элементтердин терс электрлүүлүгү(2), өтө айрымалангандыктан, бирөө экинчисинин электрондорун өзүнө тартып алып, терс заряддалган ионго (анион) , экинчиси электронун берип, оң заряддалган ионго (катион) айланат.
- Иондук байланыш (ИБ) – терс электрлүүлүгү кескин айрымаланган атомдордун, металлдардын жана металл эместердин атомдорунун ортосунда түзүлөт. (Мисалы, NaCl, K 2 O, LiF)

Иондук байланыштын мүнөздөмөсү
- Коваленттик байланыштан айрымаланып, иондук байланыштын багыты болбойт. Иондордун бири–бири менен ɵз ара аракеттениши багыттан көз каранды болбойт.
- Байланыш толугу менен иондук болбойт. Байланыштын «иондуулугу» же байланыштын иондук мүнөзү деп айтуу туурараак болот. Эгерде элементтердин терс электрлүүлүгүнүн (ТЭ) айрымасы 2 ден көп болсо (мисалы, щелочтуу металлдар жана галогендер), анда терс электрлүүлүгү жогору болгон элемент электронду тартып алат да, тиешелүү иондорду пайда кылат.

Иондук байланыштын пайда болуу механизми
- Металл эместин атому металлдын атомунун сырткы катмарындагы электрондорун тартып алат да анионго (терс заряддалган ион) айланат. Металлдын атому электрондорун берет да катионго (оң заряддалган ион) айланат. Иондор бири–бири менен электростатикалык күчтөр менен байланышкан. Бул учурда атомдор валенттик электрондорун толук берет (же алат), булуттардын капталышы, жалпы электрондук жуптардын пайда болгондугу байкалбайт.
- Ио́н (байыркы грек. ἰόν – «басат») – заряддалган бɵлүкчɵ .

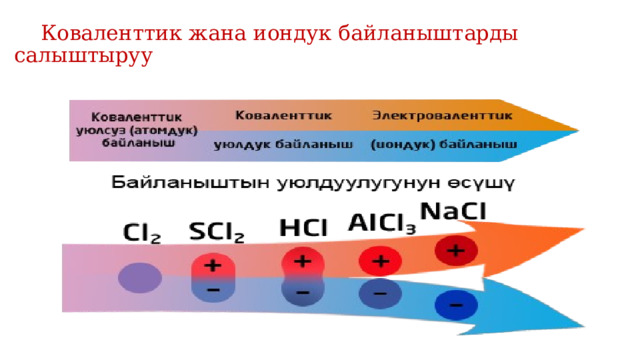
Коваленттик жана иондук байланыштарды салыштыруу

Кристаллдык торчолор
- Катуу заттар аморфтук жана кристаллдык болуп бөлүнөт (кристаллдык түзүлүштө болот).
- Кристаллдык түзүлүш мейкиндикте бөлүкчөлөрдүн белгилүү бир тартип менен жайгашуусун мүнөздөгөн түзүлүш. Бул бөлүкчөлөрдү бири–бири менен сызык аркылуу туташтырсак, кристаллдык торчо келип чыгат. Бөлүкчөлөр жайгашкан чекиттер кристаллдык торчонун түйүндөрү деп аталат.
- Кристаллдык торчонун түйүндөрүндө иондор, атомдор же молекулалар болот.
- Кристаллдык торчонун түйүндөрүндө жайгашкан бөлүкчөлөрдүн түрүнө жана алардын ортосундагы байланышка карата кристаллдык торчолорду төрт типке бөлүшөт: иондук, атомдук, молекулалык жана металлдык.



















 1,7) байланыш – иондордун ортосундагы электростатикалык тартылуу күчүнөн келип чыккан байланыш (иондорду берүү же кошуп алуу). 2. Коваленттик (∆ЭО = 0 – 1,7) байланыш – жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш. уюлсуз (∆ЭО = 0) – бир түрдүү металл эместердин атомдорунун ортосундагы байланыш. уюлдуу (0 – ар түрдүү металл эместердин атомдорунун ортосундагы байланыш. 3. Металлдык байланыш – металлдын кристаллдык торчосунун түйүндөрүндө жайгашкан атомдорду же иондорду валенттик электрондор байланыштырып турат. Бул металлдардагы жана куймалардагы байланыш (болжол менен коваленттик байланыштан 3–4 эсе начар). 4. Суутектик байланыш – суутектин атому менен терс электрлүүлүгү күчтүү болгон элементтин ортосундагы байланыш F, O, N, Cl. (болжол менен коваленттик байланыштан 15–20 эсе начар). молекула ичиндеги байланыш – белоктор, полипептиддер молекула ортосундагы байланыш – суу, спирт, аммиак, аминокислоталар ж.б. " width="640"
1,7) байланыш – иондордун ортосундагы электростатикалык тартылуу күчүнөн келип чыккан байланыш (иондорду берүү же кошуп алуу). 2. Коваленттик (∆ЭО = 0 – 1,7) байланыш – жалпы электрондук жуптардын пайда болушунан келип чыккан байланыш. уюлсуз (∆ЭО = 0) – бир түрдүү металл эместердин атомдорунун ортосундагы байланыш. уюлдуу (0 – ар түрдүү металл эместердин атомдорунун ортосундагы байланыш. 3. Металлдык байланыш – металлдын кристаллдык торчосунун түйүндөрүндө жайгашкан атомдорду же иондорду валенттик электрондор байланыштырып турат. Бул металлдардагы жана куймалардагы байланыш (болжол менен коваленттик байланыштан 3–4 эсе начар). 4. Суутектик байланыш – суутектин атому менен терс электрлүүлүгү күчтүү болгон элементтин ортосундагы байланыш F, O, N, Cl. (болжол менен коваленттик байланыштан 15–20 эсе начар). молекула ичиндеги байланыш – белоктор, полипептиддер молекула ортосундагы байланыш – суу, спирт, аммиак, аминокислоталар ж.б. " width="640"






 2), өтө айрымалангандыктан, бирөө экинчисинин электрондорун өзүнө тартып алып, терс заряддалган ионго (анион) , экинчиси электронун берип, оң заряддалган ионго (катион) айланат. Иондук байланыш (ИБ) – терс электрлүүлүгү кескин айрымаланган атомдордун, металлдардын жана металл эместердин атомдорунун ортосунда түзүлөт. (Мисалы, NaCl, K 2 O, LiF) " width="640"
2), өтө айрымалангандыктан, бирөө экинчисинин электрондорун өзүнө тартып алып, терс заряддалган ионго (анион) , экинчиси электронун берип, оң заряддалган ионго (катион) айланат. Иондук байланыш (ИБ) – терс электрлүүлүгү кескин айрымаланган атомдордун, металлдардын жана металл эместердин атомдорунун ортосунда түзүлөт. (Мисалы, NaCl, K 2 O, LiF) " width="640"



























