
«Изучение свойств соды различного состава»

ЦЕЛЬ ИССЛЕДОВАНИЯ
- изучение свойств различных видов соды и связи между свойствами и применением этих веществ.

ЗАДАЧИ И МЕТОДЫ ИССЛЕДОВАНИЯ
- изучить исторические сведения о различных содах;
- изучить их свойства и получения;
- ознакомиться с интересными фактами о различных содах;
- изучить эффективность использования пищевой, кальцинированной и каустической соды;
Предмет исследования : каустическая сода, пищевая сода, кальцинированная сода.
Методы исследования : изучение и анализ литературы; наблюдение;
обобщение, выводы.

Сода – общее название технических натриевых солей угольной кислоты.
Na 2 CO 3 (карбонат натрия) - кальцинированная сода
Na 2 CO 3 ·10H 2 O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) - стиральная сода; иногда выпускается в виде Na 2 CO 3 ·H 2 O или Na 2 CO 3 ·7H 2 O
NaHCO 3 (гидрокарбонат натрия) - питьевая или пищевая сода, натрий двууглекислый, бикарбонат натрия;
NaOH – каустическая сода (гидроксид натрия).

ПИЩЕВАЯ СОДА
Это вещество знакомо всем под названием «пищевая сода». Ее формула: NaHCO 3 и имеет химические названия − гидрокарбонат натрия , бикарбонат натрия, чайная сода, питьевая сода, двууглекислый натрий.
В обычных условиях представляет собой мелкокристаллический порошок белого цвета, разлагающийся при слабом нагревании. Во влажном состоянии начинает разлагаться при комнатной температуре, растворяется в воде

ИЗУЧЕНИЕ ХИМИЧЕСКИХ СВОЙСТВ ГИДРОКАРБОНАТА НАТРИЯ
Реакция гидролиза:
NaHCO 3 + H 2 O ↔ H 2 O + CO 2 + NaOH
Среда щелочная.
Цвет индикаторной бумажки изменился на зеленой, рН=9.

ИЗУЧЕНИЕ ХИМИЧЕСКИХ СВОЙСТВ ГИДРОКАРБОНАТА НАТРИЯ
Бургундская смесь
Действия
Наблю-дения
К NaHCO 3 добавили CuSO 4 .
Уравнение реакции
Выделился газ. Выпал осадок.
2 Na 2 НCO 3 + 2 CuSO 4 + H 2 O → CO 2 + 2 Na 2 SO 4 + Cu 2 (OH) 2 CO 3
ПРИМЕНЕНИЕ ПИЩЕВОЙ СОДЫ
Применяется пищевая сода для производства красителей, наполнителей в огнетушителях, в лёгкой промышленности - в производстве резины для подошв обуви и в производстве искусственных кож, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей
Пищевая сода необходима и в кулинарии
Пищевой содовый порошок необходим в быту.


КАЛЬЦИНИРОВАННАЯ СОДА
Название кальцинированной соды произошло от того, что для получения её из кристаллогидрата приходилось его кальцинировать (то есть нагревать до высокой температуры).
Кальцинированная сода (Na 2 CO 3 ) имеет несколько названий: карбонат натрия, углекислый натрий, бельевая сода, натриевая соль угольной кислоты – всё это названия одного и того же вещества.
Физические свойства карбоната натрия: Бесцветные кристаллы или белый порошок, хорошо растворимый в воде, плавятся без разложения и разлагаются при дальнейшем нагревании.

ИЗУЧЕНИЕ ХИМИЧЕСКИХ СВОЙСТВ КАРБОНАТА НАТРИЯ
Реакция гидролиза:
Na 2 CO 3 + H 2 O → NaHCO 3 + NaOH
Среда сильнощелочная.
Цвет индикаторной бумажки изменился на синий,
рН= 12

Изучение качественного состава Na 2 СО 3
Действия
Наблю-дения
1. Обнаружение ионов Na + .
Пламя стало желтого цвета.
На железной ложечке внесли карбонат Na в пламя спиртовки.
Вывод
2. Обнаружение CO 3 2-
Выделяется бесцветный газ. Спичка гаснет
Доказали ,что в Na 2 CO 3 присутствуют ионы Na +
К раствору Na 2 CO 3 добавили HCl и внесли горящую спичку.
Получили CO₂
Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O

ПРИМЕНЕНИЕ КАЛЬЦИНИРОВАННОЙ СОДЫ

КАУСТИЧЕСКАЯ СОДА
Существуют другие названия каустической соды: едкий натр, каустик, гидроксид натрия, едкая щелочь.
Формула гидроксида натрия – NaOH.
Физические свойства – белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды и углекислый газ из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
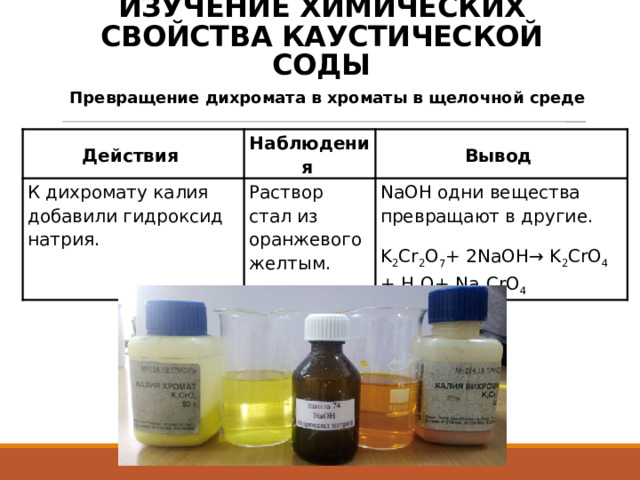
ИЗУЧЕНИЕ ХИМИЧЕСКИХ СВОЙСТВА КАУСТИЧЕСКОЙ СОДЫ
Превращение дихромата в хроматы в щелочной среде
Действия
Наблюдения
К дихромату калия добавили гидроксид натрия.
Вывод
Раствор стал из оранжевого желтым.
NaOH одни вещества превращают в другие.
K 2 Cr 2 O 7 + 2NaOH→ K 2 CrO 4 + H 2 O+ Na 2 CrO 4

ИЗУЧЕНИЕ ХИМИЧЕСКИХ СВОЙСТВА КАУСТИЧЕСКОЙ СОДЫ
Действие на соли металлов
Действия
Наблюдения
В 1 пробирку налили NiSO 4
1- Светло-зеленый осадок
Вывод
2- коричневый осадок
Во 2 пробирку налили FeSO 4
2NaOH+ NiSO 4 → Na 2 SO 4 + Ni(OH) 2
И к каждому веществу добавили NaOH
Fe 2 (SO 4 ) 3 + 6NaOH → 2Fe(OH) 3 + 3Na 2 SO 4
→

ИЗУЧЕНИЕ ХИМИЧЕСКИХ СВОЙСТВА КАУСТИЧЕСКОЙ СОДЫ
Действие на соли металлов
Действия
Наблюдения
В 3 пробирку
Вывод
СoSO 4
3- темно-синий осадок
4- темно-зеленый осадок
В 4 пробирку
СoSO 4 + 2 NaOH → Co(OH) 2 +
+ Na 2 SO 4
Fe 2 (SO 4 ) 3
И к каждому веществу добавили NaOH
FeSO 4 + 2 NaOH → Fe(OH) 2 +
+ Na 2 SO 4
→

ИЗУЧЕНИЕ ХИМИЧЕСКИХ СВОЙСТВА КАУСТИЧЕСКОЙ СОДЫ
Действие на соли металлов
Действия
Наблюдения
В 5 пробирку
Вывод
MgSO 4
5- белый осадок
В 6 пробирку
6- синий осадок
MgSO 4 + 2NaOH = Mg(OH) 2 + + Na 2 SO 4
CuSO 4 + 2 NaOH → Cu(OH) 2 +
CuSO 4
И к каждому веществу добавили NaOH
+ Na 2 SO 4
→

Применение каустической соды
Гидроксид натрия находит весьма существенное применение во многих отраслях промышленности: в производстве бумаги моющих средств, для нейтрализации кислот, как реагент или катализатор в химических реакциях, для изготовления биодизельного топлива и многое другое. В быту основное назначение гидроксида натрия – борьба с жировыми и органическими загрязнениями. Его применяют для чистки канализации, обезжиривания поверхностей, в изготовлении мыла ручным способом, отбеливании и стирке белья, борьбе с садовыми вредителями, для санитарной обработки помещений.

Спасибо за внимание












































