Федеральное агентство по образованию и науке РФ
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа №9»
Брянской области города Новозыбкова
Исследовательская работа
Тема: «Химический мониторинг водопроводной воды».
Выполнила:
Ученица 9 «В» класса
Гнутова Алина Вячеславовна
.
Научный руководитель:
учитель химии
Романченко Галина Юрьевна
2022 год
Оглавление.
Содержание работы :
Стр.
Введение…………………………………………………………………………..3
Литературный обзор……………………………………………………………...6
1.1. Влияние на организм человека повышенного содержания ионов
кальция, магния, карбонат, гидрокарбонат ионов (жесткости ) и ионов хлора
и железа.................................................................................................................. 5
1.2. Гигиенические требования к качеству питьевой воды……………………8
1.3 Методы устранения избытка ионов в домашних условиях.........................9
Экспериментальная часть……………………………………………………….11
2.1. Определение общей жёсткости воды…………………………..………….11
2.2. Определение устранимой и остаточной жёсткости……...……………….11
2.3. Определение концентрации катионов кальция и магния….……………..12
2.4. Определение концентрации катионов железа……….………….………..12
2.5. Определение щёлочности………………………….……………….............13
2.6.Определение концентрации хлорид-ионов (аргентометрическим
методом по Мору)………………………………………………………… …...14
2.7. Определение окисляемости (перманганатным методом)………………..14
2.8. Обсуждение результатов……………………………………………...........16
Выводы…………………………………………………………..……………….19
Заключение ...........................................................................................................19
Литература…………………………………………………….…………………20
Приложение...........................................................................................................21
Введение.
Питьевая вода - важный элемент необходимый для существования всего живого на планете. С давних пор люди при выборе места для поселения отдавали предпочтение местности, находящейся вблизи какого-либо источника живительной влаги: реки, озера, моря, океана. Освоение участка под строительство жилища начиналось с определения места прохождения грунтовых вод для возведения колодца.
Отправляясь в дальние странствования, будь то по морю или по суше, мореплаватели и путешественники обязательно заботились о запасах питьевой воды. Ничего не имеет такой ценности для путника в жаркой местности, как глоток воды. Важнее только воздух, без которого жизнь нереальна. Без возможности утоления жажды, жизнь в теле человека поддерживается всего 2–3 дня. Без пищи можно продержаться значительно дольше. По этой причине надлежит с уважением и благодарностью относится к дарам природы.
Здоровье людей напрямую зависит от экологии и водных резервов. Наше бережное отношение к водным ресурсам, позволит качественно расходовать и так небольшие их запасы. Ведь пригодной воды для питья немного, всего 1% от общей площади, преобладания воды над сушей.
Вода - основа жизни человека Тело человека на 60–70% состоит из воды. Интересно, что эмбрион на пятом месяце жизни в утробе матери, состоит на 94% из воды. Но человеческий организм так устроен, что с возрастом он теряет влагу. Начиная с младенческого возраста, показатель уровня содержания воды составляет 85% всего тела. С возрастом коэффициент наполненности водой уже становится 85–70%. У пожилых людей уровень насыщенности влагой снижается до 70–50%.
Все живые существа состоят из воды:
животные – на 75%, морские обитатели – на 80%, моллюски – на 99%. Большинство овощей имеют в своем основном составе воду: огурцы — 96%, помидоры – 95%, яблоки – 85%, картофель – 76%. Рекордсменом по содержанию воды среди пищевых культур является арбуз, он на 97% состоит из воды.
Человеку необходима для использования вода на протяжении всей его жизни: для утоления жажды, приготовления пищи, умывания, купания и т.д. Одним жителем планеты за год потребляется примерно от 30 до 60 тонн воды только в процессе питания. Ежедневно мы теряем большое ее количество с потом, дыханием и посредством других выделительных систем. Очевидно, что эти потери нужно непременно восполнять. Не следует ограничивать себя в питье. Человеку для пополнения внутренних водных запасов нужно ежедневно выпивать от 1,5 до 2 литров чистой, фильтрованной, не газированной воды. При этом полезнее пить понемногу и часто. Обязательно перед приемом пищи и не ранее, чем через 1 час после трапезы.
Польза воды для организма
Соблюдать питьевой режим необходимо на протяжении всей жизни. Во избежание таких неприятных симптомов, как быстрая утомляемость, вялость, раздражительность, повышение артериального давления и прочих показателей. Доведение потребления чистой воды до необходимой нормы увеличивает продолжительность жизни в среднем на 15–20 лет. Вода стимулирует полную регенерацию тканей и всех функциональных процессов организма. Она улучшает пищеварение, принимая активное участие в усвоении необходимых элементов, получаемых с пищей. Тем самым, способствуя ускорению обмена веществ и восстановлению функций иммунной системы. За счет чего происходит быстрое оздоровление и омоложение всего организма, нормализация веса.
Вода повышает общую энергию. Известно, что человеческий организм получает «быструю» энергию из двух источников: вода и углеводы (сахар). Согласитесь, первый вариант намного предпочтительней по многим факторам! Все потому, что вода легко перерабатывается и выводится организмом, попутно захватив с собой еще и шлаки с токсинами. Чего не скажешь об углеводах — их избыток переводится в жировые запасы, от которых очень сложно избавиться. Ощущение голода и жажды возникает одновременно при снижении уровня энергии. Человек, путая эти сигналы, стремится удовлетворить один из них, чаще всего голод. Не догадываясь о том, что жажда часто маскируется под аппетит. Не нужно спешить есть при первых признаках голода. Сначала необходимо восполнить водные запасы своего организма, помогая тем самым ему очиститься, восстановиться. И попутно подготовить пищеварительную систему к следующему принятию пищи.
Всеми вышеперечисленными очищающими, оздоравливающими, восстанавливающими и омолаживающими свойствами обладает именно вода. Она должна быть обязательно чистая, высокого качества и степени очистки. Потому что все напитки, такие как чай, кофе, соки и тому подобные - воспринимаются организмом как еда. Также вода имеет первостепенное значение в усвоении организмом пищи, обогащая ее необходимой энергией. После чего частички пищи, расщепленные на микроэлементы, доставляют все питательные вещества вместе с энергией всему организму. Оказывается, без воды продукты питания не имеют никакой питательной и энергетической ценности, так как просто не усваиваются. Без участия крови, состоящей на 90% из воды, питательные вещества неспособны самостоятельно транспортироваться к органам и тканям человеческого организма.
Итак, можно подвести итоги, что вода не только источник жизни, гарантия здоровья, и полноценной жизнедеятельности организма. Она гарантия бодрого самочувствия, отличного настроения и привлекательного внешнего облика на многие года. Здоровье - это так просто!
Целебное действие воды определяется повышенным содержанием биологически активных компонентов (растворенных неорганических или органических веществ, газов) и физико-химическими свойствами[7]. В настоящее время их роль неизмеримо возросла, что связано прежде всего с обострившейся проблемой водоснабжения.
Поэтому вода требует контроля за качеством химического состояния и анализа соответствия ее требованиям ГОСТа, что является целью данной учебно-исследовательской работы.
Основные задачи работы:
Сделать анализ проб водопроводной воды г Новозыбкова на содержание в ней катионов кальция, магния, железа; карбонат- и гидрокарбонат – ионов, хлорид – ионов, а также таких показателей качества воды, как рН, щёлочность, жёсткость (общая, устранимая и остаточная) и окисляемость.
Сравнить эти показатели с гигиеническими требованиями к качеству питьевой воды
Изучить влияние избытка катионов кальция, магния, железа; карбонат- и гидрокарбонат – ионов, хлорид – ионов на организм человека и методы приведения водопроводной воды к гигиеническими требованиями к качеству питьевой воды
Изучить методы устранения избытка ионов в домашних условиях и их эффективность.
Исследование водопроводной воды проводилось на базе школы №9: улица Голодеда 22 с октября по декабрь 2022 года.
Литературный обзор.
1.1.Влияние на организм человека повышенного содержания ионов кальция, магния, карбонат, гидрокарбонат ионов (жесткости ) и ионов хлора и железа.
Абсолютно чистая вода в природе не встречается. Соприкасаясь с другими макро- и микроэлементами, она обогащается различными минералами, в частности, солями кальция и магния. Именно их содержанием обусловлено такое свойство, как жесткость: чем больше в воде солей кальция и магния, тем она жестче.
В нашей стране жесткость воды выражается в миллиграммах-эквивалентах на литр (мг-экв/л). Очень мягкая вода – до 1,5 мг-экв/л, мягкая – от 1,5 до 4 мг-экв/л, вода средней жесткости – от 4 до 8 мг-экв/л, жесткая – от 8 до 12 мг-экв/л и очень жесткая – более 12 мг-экв/л. Допустимый предел жесткости воды для централизованного водоснабжения – 7 мг-экв/л.
Доказано, что жесткая вода негативно влияет на организм. При взаимодействии с мылом образуются «мыльные шлаки», которые не смываются с кожи, разрушают естественную жировую пленку, защищающую от старения и неблагоприятных климатических факторов, забивают поры, образуют на волосах микроскопическую корку, тем самым вызывая сыпь, зуд, сухость, перхоть, шелушение. Кожа не только преждевременно стареет, но и становится чувствительной к раздражениям и расположенной к аллергическим реакциям.
Высокая жесткость ухудшает органолептические свойства питьевой воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения. Соли кальция и магния, соединяясь с животными белками, которые мы получаем из еды, оседают на стенках пищевода, желудка, кишечника, осложняют их перистальтику (сокращение), вызывают дисбактериоз, нарушают работу ферментов и в конечном итоге отравляют организм. Постоянное употребление воды с повышенной жесткостью приводит к снижению моторики желудка и накоплению солей в организме.
От воды, переполненной ионами кальция и магния, чрезмерно страдает сердечно-сосудистая система. Продолжительное использование жесткой воды чревато возникновением заболеваний суставов (артритов, полиартритов), образованием камней в почках и желчных путях.
Кроме того, что жесткая вода отрицательно влияет на здоровье, еще приносит много неприятностей в быту. Она нежелательная для мытья посуды и стирки – посуда тускнеет, а ткани быстро изнашиваются. Огромный вред наносится бытовой технике: бойлерам, стиральным и посудомоечным машинам, электрочайникам и кофеваркам. Соли кальция и магния, осаждаясь на нагревательных элементах, образуют твердые известковые отложения (накипь) и довольно скоро выводят оборудование из строя.
Следы жесткой воды видны невооруженным глазом: появляется белый налет на трубах, сантехнике, в системе отопления, бытовой технике, увеличивается расход моющих средств, «сворачивается» мыло при мытье и стирке, образуются пенообразные шлаки на коже и поверхностях.
Железо — естественный минерал, который всегда имеется в любой воде в определенном количестве. Попадает он в нее вследствие естественных природных процессов — разрушения и выветривания каменных пород, а также старения и коррозии чугунных и стальных водопроводов.
Только двадцать процентов опасных веществ попадают в человеческий организм с потребляемыми продуктами и через органы дыхания, остальные – вместе с водой. Это относится и к железу. Избыточное его содержание крайне отрицательно сказывается на репродуктивной функции человека, а также приводит к дефициту такого важного микроэлемента, как цинк.
Повышенная концентрация железа может стать причиной развития дерматитов и аллергических заболеваний. Соединения кислорода и железа имеют канцерогенные свойства. Они являются причиной изменения ДНК-клеток и перерождения их в раковые. Железо подпитывает их, ведет к их росту. Увеличение содержания железа в крови увеличивает риск заболеть раком легких, толстой и тонкой кишки, мочевого пузыря и желудка.
Человеческому организму необходимо, чтобы железо функционировало должным образом, но оно, как и многие другие вещества, токсично при высоких дозах. Вред железа для организма связан исключительно с его избытком. И к счастью, невозможно выпить столько воды, чтобы появилась интоксикация железом.
Хлориды обладают высокой растворимостью и поэтому присутствуют во всех природных водах в основном в виде кальциевых, натриевых и магниевых солей. Их попаданию в воду способствует вымывание поваренной соли и прочих хлористых соединений из пластов пород вулканического происхождения.
Повышенная концентрация хлоридов даёт воде солёный вкус и делает её непригодной для питья, хозяйственных нужд и использования в технических целях
Перенасыщенная хлоридами вода способна вызвать поражение слизистых оболочек, глаз, кожи и дыхательных путей. После употребления такой воды нарушается водно-солевой баланс и работа пищеварительного тракта, появляются отёки и склонность к заболеваниям мочеполовой системы. Избыток солей приводит к изменениям в кровеносных сосудах, перегружает работу сердца и почек, повышает артериальное давление и может заметно усугубить течение сердечно-сосудистых заболеваний.
Вода с повышенным содержанием хлоридов вредна не только для человека. Такой раствор негативно влияет на здоровье домашних и сельскохозяйственных животных, на рост и развитие аграрных культур и растений.
В быту и на производстве слишком солёная вода агрессивно воздействует на металлические поверхности, заметно увеличивая интенсивность их коррозии. От такой воды на поверхности нагревательных элементов со временем образуется накипь. Это снижает их теплопроводность, увеличивает расход энергии и приводит к необратимым поломкам оборудования.
1.2. Гигиенические требования к качеству питьевой воды.
Требования к качеству питьевой воды определяются ГОСТ 2874-82 «Вода питьевая. Гигиенические требования и контроль за качеством», что распространяется на питьевую воду, подаваемую централизованными хозяйственно-питьевыми системами водоснабжения и водопроводами, используемую одновременно для питьевых, хозяйственных, технических и коммунально-бытовых целей; не распространяется на воду при нецентрализованном использовании местных водоисточников без разводящей сети труб и на опреснённую воду.
В ГОСТ 2874-82 изложение нормативных требований дано в 3 группах: бактериологические показатели, показатели токсических веществ воды, органолептические показатели воды.
Нормативные показатели бактериального состава питьевой воды относятся к общему бактериальному загрязнению и содержанию бактерий группы кишечной палочки (косвенный показатель безопасности воды в эпидемическом отношении). Общее количество бактерий в 1 мл неразбавленной воды должно быть не более 100. Количество бактерий группы кишечной палочки, определяемых на плотной, элективной среде с применением концентраций бактерий на мембранных фильтрах, в 1 л воды (коли-индекс) должно быть не более 3.
Показатели безвредности химического состава воды включают нормы для веществ, встречающихся в природных водах, добавляемых к воде в процессе её обработки в виде реагентов и появляющихся в результате промышленного и сельскохозяйственного загрязнения водоисточников.
Органолептические свойства характеризуются интенсивностью допустимого изменения органолептических показателей воды (запах, привкус, цветность, мутность). Запах воды при 20 оС и при подогревании до 60 оС должен быть не более 2 баллов; привкус при 20 оС – не более 2 баллов; цветность по платино-кобальтовой или имитирующей шкале – не более 20о; мутность по стандартной шкале – не более 1,5 мг/л. Вода не должна содержать различаемых невооружённым глазом водных организмов и не должна иметь на поверхности плёнку.
Таблица 1.
| Мутность, мг/л Цветность, град Запахи и привкусы при 200С, балл Водородный показатель Общая жесткость, мг-экв/л Фтор, мг/л Железо, мг/л Марганец, мг/л Хлориды, мг/л Сульфаты, мг/л Сухой остаток, мг/л Остаточный алюминий, мг/л Медь, мг/л Цинк, мг/л Гексаметофосфат, мг/л Триполифосфат, мг/л Полиакриламид, мг/л Бериллий, мг/л Молибден, мг/л Мышьяк, мг/л Свинец, мг/л Селен, мг/л Стронций, мг/л Нитраты, мг/л Общее количество бактерий в 1 мл Колииндекс Колититр | до 1,5 до 20 до 2 6 … 9 до 7 0,7 … 1,5 до 0,3 до 0,1 до 350 до 500 до 1000 до 0,5 до 1,0 до 0,5 до 3,5 до 3,5 до 2 до 0,0002 до 0,25 до 0,05 до 0,03 до 0,001 до 7,0 до 45,0 до 100 до 3 300 |
1.3 Методы устранения избытка ионов в домашних условиях
1.Самый простой способ снижения железа в воде - отстаивание
Воду заливают в резервуар и выдерживают 2-3 суток. За это время нерастворимые частицы осаждаются на дно. Такой метод снижения железа в воде позволяет удалить только твердые нерастворимые частицы, содержание растворенных солей жесткости остается неизменным. Еще один недостаток отстаивания для уменьшения железа в воде - необходимость наличия резервуара значительного объема. Кроме того, очистка воды от излишков ионов таким способом слишком долгая, для осаждения примесей нужно не менее суток.
Очистить воду от временной жесткости можно кипячением
При кипячении воды гидрокарбонаты кальция и магния,железа разлагаются. Кислотный остаток в виде углекислого газа испаряется. Соли кальция переходят в нерастворимую форму и осаждаются на дне и стенках емкости. К недостаткам кипячения как метода удаления кальция, железа и магния из воды относятся:
Высокая энергоемкость. В процессе очистки расходуется большое количество тепловой энергии.
Недостаточная степень очистки. При кипячении снижается содержание гидрокарбонатов. Железосодержащие соли сильных кислот не разлагаются при высокой температуре, содержание хлоридов остается на прежнем уровне, концентрация сульфатов снижается незначительно.
На практике очистить воду от ионов кальция , железа и магния кипячением применяется только в быту, при невозможности фильтрации другим способом.
Ионообменные фильтры - наиболее эффективный метод очистки воды от ионов кальция и железа.
Принцип действия фильтров для очистки воды от железа основан на обмене ионов кальция и железа на ионы натрия. Нерастворимые соли задерживаются в ионообменной смоле. Такой способ удаления кальция из воды широко применяется в промышленных системах водоподготовки питьевой и технической воды. Ионообменные фильтры от железа в воде:
Обеспечивают высокий уровень очистки питьевой воды от кальция. Такой метод очистки воды от кальция и железа пригоден даже для очень жесткой воды. Фильтры умягчения - самый распространенный тип фильтров для очистки воды от ионов кальция.
Имеют возможность восстанавливать рабочий ресурс главного фильтрующего элемента (ионообменной смолы). Для регенерации применяют NaCl - источник ионов натрия. Соли жесткости удаляют промывкой.
Снижают постоянную и временную жесткость. фильтры для удаления кальция из воды на основе ионного обмена снижает содержание карбонатов, гидрокарбонатов, сульфатов и хлоридов кальция. Фильтры для воды от кальция также снижают содержание других двухвалентных катионов.
Самым распространенными фильтрующими материалами для очистки воды используют адсорбенты. Они представляют собой пористые материалы, выпускаемые промышленностью(кокс, активированный уголь, катионит марки КУ-2-3 и анионит марки АВ-17-8), являющимися местными природными сырьевыми ресурсами(торф, сапропель) и отходами местных промышленных предприятий(лигнин. керамзитовая крошка)
В установках по очистке воды в домашних условиях применяются фильтры с активным углем. Наиболее распространенным фильтрующим материалом является активный уголь БаУ-МФ.
Экспериментальная часть.
Мы считаем необходимым повести и проводить исследование состава водопроводной воды г.Новозыбкова. Вода анализировалась по следующим показателям: рН; окисляемость; общая, постоянная и устранимая жёсткость; щёлочность, а также концентрациям катионов железа (II) и железа (III); кальция, магния и хлорид-ионов.[1] Методики определения данных показателей приведены ниже.
2.1. Определение общей жёсткости воды.
Ход определения.
К 100 мл пробы воды или к другому объёму, доведённому до 100 мл, приливают 5 мл буферного раствора. Щёлочность устраняют добавлением эквивалентного количества 0,1 н раствора соляной кислоты. После тщательного перемешивания прибавляют около 5 капель раствора индикатора или 0,1-0,2 г сухой смеси индикаторов. Жидкость перемешивают и титруют 0,05 М раствором комплексона III до перехода красной окраски в фиолетовую. Затем по каплям при тщательном перемешивании титруют до появления синей окраски исследуемого раствора. Изменение окраски подтверждают прибавлением ещё 1 капли (0,02 мл) титрованного раствора.
Общую жёсткость в мг-экв/л вычисляют по формуле:
 , где
, где
a – объём 0,05 М (0,1 н) раствора комплексона III, израсходованного на титрование, мл.
k – поправочный коэффициент для приведения концентрации комплексона III к 0,05 М.
V – объём пробы, взятой для титрования, мл.
2 – число грамм-эквивалентов жёсткости, соответствующее 1 молю комплексона [9].
2.2. Определение устранимой и остаточной жёсткости.
Ход определения.
В коническую колбу на 250 мл отмерить пипеткой 100 мл исследуемой воды. Термостойким карандашом по стеклу отметить уровень воды в колбе. Закрыть колбу воронкой и кипятить 1 час. По мере испарения воды в колбу осторожно приливать дистиллированную воду до метки. При кипячении образуется осадок карбоната кальция. После охлаждения профильтровать кипячёную воду через сухой фильтр в чистую сухую колбу. Внести 2-3-капли метилоранжа. Оттитровать соляной кислотой до появления оранжевой окраски.
Остаточную жёсткость (в мг-экв/л) вычисляют по формуле:
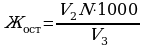 , где
, где
V2 – объём раствора HCl на титрование пробы после кипячения, мл;
V3 – объём пробы воды, мл.
N – нормальность рабочего раствора соляной кислоты.
Устранимую жёсткость (в мг-экв/л) вычисляют по формуле:
 , где
, где
V1 – объём раствора HCl на титрование пробы до кипячения, мл;
Остальные обозначения те же, что и при определении Жост [8].
2.3. Определение концентрации катионов кальция и магния.
Ход определения.
Для определения кальция к 100 мл исследуемой воды прибавляют 5 мл приблизительно 10%-ного (2 н) раствора едкого натра (кали) и от 0,1 до 0,2 г смеси индикатора с солью (раствор должен иметь розовый цвет) или смеси индикатора с солью и нафтоловым зелёным Б. После чего медленно титруют титрованным раствором комплексона III до появления интенсивной фиолетовой окраски (когда применяют смесь мурексида с нафтоловым зелёным Б, то до чисто-синей окраски). Mg2+ при этом осаждается в виде Mg(ОН)2 и не реагирует с комплексоном.
Содержание кальций-ионов в мг-экв/л вычисляют по формуле:
 , где
, где
V(трилона) – объём израсходованного 0,1 н титрованного раствора комплексона III, мл.
k – поправочный коэффициент для приведения концентрации раствора комплексона к 0,1 н.
N – нормальность раствора комплексона III.
100 – количество пробы, взятой для определения, мл.
Зная объём раствора, израсходованного на титрование Са2+ и Mg2+ (общая жёсткость) с эриохромом чёрным Т, и объём раствора, пошедший на титрование Са2+, находят объём раствора комплексона, который расходуется на титрование Mg2+:
c(Mg2+) = (с(Са2+) + c(Mg2+)) – c(Cа2+) [3].
2.4. Определение концентрации катионов железа.
Ход определения.
Опыт 1. Определение Fe3+.
В мерную колбу на 50 мл отмеряют пипеткой 25 мл исследуемой воды, прибавляют 5 мл 1 М раствора соляной кислоты и 15 мл 10% раствора сульфосалициловой кислоты. Дистиллированной водой доводят объём до 50 мл.
В другую мерную колбу на 50 мл помещают 25 мл дистиллированной воды, те же объёмы реактивов и отмеряют из бюретки такой же объём стандартного раствора Fe3+, чтобы концентрация Fe3+ незначительно отличалась от его содержания в исследуемой воде (приблизительно одинаковая интенсивность окраски исследуемого и стандартного растворов).
Через 10 мин приступают к определению оптической плотности полученных растворов на ФЭК (λ = 490 нм с сине-зелёным фильтром).
Содержание Fe3+ (c(Fe3+), мг/л) рассчитывают по формуле:
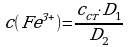 , где
, где
сст – концентрация Fe3+ в стандартном растворе, мг/л,
D1 и D2 – оптические плотности исследуемого и стандартного растворов соответственно. [2]
Опыт 2. Определение суммы ионов Fe3+ и Fe2+.
В мерную колбу на 50 мл отмеряют пипеткой 25 мл исследуемой воды. Приливают 15 мл сульфосалициловой кислоты и 5 мл 25% водного раствора аммиака. Доводят объём дистиллированной водой до метки. В другой мерной колбе готовят стандартный раствор.
Через 10 мин проводят колориметрирование растворов (жёлтая окраска) на ФЭК с λ = 400 нм.
Суммарную концентрацию ионов Fe3+ и Fe2+ (с (Fe3+ + Fe2+), мг/л) в исследуемом растворе определяют по формуле, приведённой выше (опыт 1).
Содержание ионов Fe2+ в исследуемом растворе находят по формуле:
с(Fe2+) = с (Fe2+ + Fe3+) – с (Fe3+) [8].
2.5. Определение щёлочности.
Ход определения.
К 100 мл пробы воды прибавляют 5-6 капель фенолфталеина. Если раствор приобрёл малиновую окраску, то титруем рабочий раствор раствором соляной кислоты до обесцвечивания окраски (это объём V1). Если раствор остался бесцветным, то к рабочему раствору прибавляем 5 капель смешанного индикатора (или метилоранжа) и титруем соляной кислотой до цвета утренней росы (ещё не розовый, но уже не жёлтый). Считая от нулевой точки – это объём V2.
Если раствор после прибавления фенолфталеина приобрёл малиновое окрашивание, то можно сделать вывод, что в растворе присутствуют карбонат-ионы. Содержание карбонатов в мг-экв/л вычисляют по формуле:
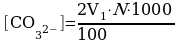 ,
,
если окраска раствора не изменилась, то в анализируемой пробе карбонаты отсутствуют.
Содержание гидрокарбонатов в мг-экв/л вычисляют по формуле:
 .
.
Содержание общей щёлочности в мг-экв/л вычисляют по формуле:
 , где
, где
V1 – объём HCl, пошедший на титрование в присутствии фенолфталеина.
V2 – объём HCl, пошедший на титрование в присутствии фенолфталеина и смешанного индикатора (или метилоранжа).
N – нормальность раствора соляной кислоты [5].
2.6. Определение концентрации хлорид-ионов (аргентометрическим методом по Мору).
Ход определения.
Для определения берут 100 мл пробы воды. Кислые и щелочные пробы нейтрализуют едким натром или серной кислотой по фенолфталеину, прибавив ничтожно малый избыток кислоты, чтобы раствор после нейтрализации был бесцветным. Пробы, рН которых составляет 7-10, предварительно не подготавливают. Затем к пробе приливают 1 мл раствора хромата калия и при постоянном перемешивании титруют раствором нитрата серебра до перехода лимонно-жёлтой окраски в оранжево-жёлтую. Таким же образом проводят холостое определение с бидистиллятом.
Содержание хлорид ионов в мг-экв/л вычисляют по формуле:
 , где
, где
V – объём раствора нитрата серебра, пошедшего на титрование пробы, мл.
N – нормальность титрованного раствора.
k – поправочный коэффициент к нормальности титрованного раствора AgNO3 [4].
2.7. Определение окисляемости (перманганатным методом).
Установка титра перманганата калия по щавелевой кислоте.
Ход определения.
В коническую колбу помещают 100 мл воды, прибавляют 25 мл серной кислоты (1:3), 10 мл 0,01 н раствора перманганата калия и кипятят 10 минут. По окончании кипячения к раствору приливают 25 мл 0,01 н раствора щавелевой кислоты, избыток которой оттитровывают перманганатом калия до появления слабо розовой окраски.
Окисляемость рассчитывают по формуле (мг-экв/л):
 ; где
; где
О – количество кислорода.
V1(KMnO4) – количество 0,01 н KМnO4, прилитое к воде для окисления органических примесей.
V1(KMnO4) – количество KМnO4, пошедшее на титрование избытка С2Н2О4.
V (C2H2O4) – количество раствора СООН-СООН.
c (KMnO4) – концентрация перманганата калия.
с (C2H2O4) – концентрация щавелевой кислоты.
8 – количество О2, соответствующее 1 мл 0,01 н KМnO4 [7].
2.8 Обсуждение результатов.
Анализ воды из под крана последний раз проводился в октябре и декабре 2022 года
Бланк описания забранной воды из под крана
1. Дата-октябрь-декабрь 2022 года.
2. Автор: Ученица 9 «В» класса Гнутова Алина под руководством учителя химии Романченко Г.Ю.
3. Адрес: улица Голодеда 22.
4. Физические свойства воды:
а) температура- 15 С0
б) прозрачная;
в) цвет-без каких-либо оттенков;
г)запах - не определяется;
д) вкус – сладковатый.
Интенсивность запаха и вкуса слабая.
5. Химические свойства:
а) наличие осадка (налета) -наличие на нагревательных приборах ржавого налета.
б) жесткость – умеренно-жесткая.
Другие химические свойства не определялись.
6. Хозяйственное использование: хозяйственно- питьевая.
7. Санитарное состояние: хорошее.
8. Возможное загрязнение вод: бытовой мусор.
9.Оборудование источника: железобетонные трубы разного диаметра.
Анализ химического состава водопроводной воды проводился по таким важнейшим показателям как: pH, щелочность, общая жесткость, постоянная, временная жесткость, устранимая и остаточная жесткость, концентрация ионов кальция, магния, суммарная концентрация ионов железа, концентрация хлорид ионов, окисляемость. Химический состав анализировался в октябре и декабре 2022 года. В таблицах приведены данные по анализируемым показателям.
Таблица 2.
Концентрации показателей водопроводной воды.
| Анализируемые показатели | Минимальное значение | Максимальное значение | Среднее значение |
| pH | 7,86 | 7,95 | 7,9 |
| Щелочность, ммоль-экв/л | 4,1 | 4,95 | 4,52 |
| Общая жесткость, ммоль-экв/л | 2,36 | 2,76 | 2,55 |
| Устранимая жесткость, ммоль-экв/л | 2,36 | 2,76 | 2,55 |
| Концентрация катионов кальция, ммоль-экв/л | 1,8 | 2,06 | 1,91 |
| Концентрация катионов магния, ммоль-экв/л | 0,56 | 0,7 | 0,64 |
| Суммарная концентрация железа, мг/л | 0,33 | 0,43 | 0,38 |
| Концентрация хлорид ионов, ммоль-экв/л | 1,1 | 1,55 | 1,38 |
| Окисляемость, мг/л | 9,7 | 11,3 | 10,64 |
Результаты, представленные в таблице 2 , свидетельствуют о том, что по некоторым показателям исследуемая вода не соответствует предъявляемым требованиям. В первую очередь следует отметить превышение ПДК по железу (0,3 мг/л). Одним из важнейших показателей качества воды является её жёсткость. Нами была определена общая, концентрации ионов кальция и магния, которые относятся к числу важнейших, т.е. во многом определят пригодность воды в различных процессах, в том числе и для питья. Результаты анализа показали, что вода умеренно жёсткая. Содержание катионов кальция на 69% больше чем магния. Щёлочность определяется наличием в воде анионов слабых кислот. Как правило, в воде карбонатная щёлочность, обусловленная наличием анионов CO32– и НСО3–, существенно преобладает над другими видами щёлочности, поэтому без большой погрешности мы принимали общую щёлочность, равной карбонатной, но с фенолфталеином родниковая вода реакции не дает, следовательно, общая щелочность будет определяться только гидрокарбонат ионами. Данные таблицы свидетельствуют о высокой щёлочности водопроводной воды, так как вода считается щелочной, если значение общей щёлочности превышает 2 мг-экв/л. Одним из важнейших показателей качества воды является содержание в ней растворённых органических веществ. Установить их точный качественный и количественный состав не представляется возможным, поэтому на практике концентрацию органических примесей в воде выражают косвенным методом, определяя окисляемость воды. Сравнивая полученный результат с ПДК (3 мг/л), можно сделать вывод о том , что исследуемая вода соответствует требованиям. Проанализировав экспериментальные данные, нами было установлено, что по таким показателям как щелочность, содержание железа вода не соответствует предъявляемым требованиям.
Конечно, концентрация определяемых ионов в воде не постоянна и колеблется в зависимости от времени года и от сезонных условий(мы проводили такие исследования), но процесс разбавления не такой сильный даже в самый дождливый период года, чтобы концентрации ионов пришли в норму. Поэтому необходимо в домашних условиях использовать специальные методы устранения излишка содержания ионов кальция, магния , карбонат и гидрокарбонат ионов, а так же ионов железа, так как их избыток негативно влияет на организм человека.
Барьер-Норма
1,65 литра очищенной воды
Объем воронки 1.5 литра
Общий объем 3 литра.
Выпускается с воронками различных цветов- белый, индиго, малахит.
Сменная кассета "БАРЬЕР-6" для жесткой воды благодаря повышенному содержанию ионообменной смолы более эффективно снижает жесткость воды. Высококачественный кокосовый активированный уголь очищает от активного хлора, органических и хлорорганических загрязнителей, пестицидов и нефтепродуктов, устраняет неприятные запахи и привкусы. Обработка активированного угля серебром предотвращает возможность размножения бактерий внутри фильтра. Высокоэффективная ионообменная смола очищает от ионов, токсичных металлов и снижает жесткость воды.
Мы решили проверить на сколько эффективно работает такой фильтр.
Водопроводную воду, мы пропустили через фильтр и проделали вышеперечисленные анализы , которые отразили в графиках.[Приложение 1-8 ] Из графиков видно, что после пропускания через фильтр 3 и 10 литров воды происходит резкое снижение концентрации катионов, обуславливающих жесткость воды [Приложение 1].При этом доли связывания фильтрующим материалом ионов кальция составляет почти 90%, а катионов магния 45%. [Приложение 3,5]. Однако следует отметить, что этот показатель очень быстро снижается по мере пропускания через насадку новых порций загрязненной воды [Приложение 2,4,6]. Уже на отметке в 100 литров степень адсорбции катионов кальция и магния снижается до 40%, то есть более половины данных ионов переходят в очищенную воду. В дальнейшем происходит медленное понижение степени адсорбции ионов и в нормативной точке 350 литров степень адсорбции составляет 27,5%.
Результаты наших исследований показывают большую эффективность кассеты №6 фильтра "Барьер" по устранению ионов кальция и магния в воде. Обращает на себя внимание тот факт, что снижение концентрации катионов кальция и магния, и анионов гидрокарбонат [Приложение 7,8]. происходит достаточно синхронно, и даже после большого объема пропущенной воды адсорбционная способность кассеты не снижается до нуля. Следовательно данный вид фильтра эффективен для понижения общей жесткости воды, но не эффективен при устранении повышенного содержания ионов хлора, так как наблюдаемые отклонения составляют 5-7%, что лежит в пределах ошибки эксперимента.
Выводы:
1. Водопроводная вода г. Новозыбкова , прошедшая централизованную очистку , не соответствует санитарно-гигиеническим показателям по требованиям ГОСТа
2. Избыток ионов кальция, магния и железа негативно влияет на организм человека и его нужно устранять.
3. В домашних условиях удаление временной жесткости и избытка ионов железа, кальция и магния боле эффективно при применении бытового фильтра "Барьер", который помогает устранять нежелательные для организма человека вещества.
Заключение.
Данную работу "Экологический мониторинг водопроводной воды" выполняла ученица 9 в класса Гнутова Алина под руководством учителя химии и биологии Романченко Галины Юрьевны с октября по декабрь 2022 года.
В нашей школе анализ воды проводится с 2009 года, поэтому мы регулярно следим за качеством поступающей к нам воды из водопровода. Можно сказать, что качество воды не меняется в лучшую сторону.
Исходя из проделанной работы можно сделать выводы, что вода территории Брянской области г. Новозыбкова с повышенным содержанием щелочности, средней жесткостью и содержанием большого количества железа, а избыток ионов кальция, магния и железа, повышенная щелочность негативно влияют на здоровье человека, поэтому их нужно устранять. Самым доступным и эффективным методом устранения избытка ионов кальция, магния и железа в домашних условиях является использования бытового фильтра "Барьер". Единственным условием его использования является частая смена кассет, так как при длительном использовании кассеты, адсорбция устраняемых ионов уменьшается.
Литература.
Алексеев, В.Н. Количественный анализ / В.Н. Алексеев. – М.: Химия, 1972. – 242с.
Ананьевская, М.П. Руководство по химическому анализу воды / М.П. Ананьевская. – Новочеркасск, 1969. – 320с.
Логинов, Н.Я. Аналитическая химия / Н.Я. Логинов, А.Г. Воскресенский, И.С. Солодкин. – М.: Просвещение, 1979. 460с.
Оценка и регулирование качества окружающей природной среды / под ред. А.Ф. Порядина, А.Д. Хованского. – М.: Прибой, 1996. – 248с.
Савченко, П.С. Методы химического и микробиологического анализа воды / П.С. Савченко, Ф.Г. Дятловицкая, В.А. Ярошенко. – Киев: Госмедиздат УССР, 1961. – 360с.: ил.
Таубе, П.Р. Практикум по химии воды / П.Р. Таубе, А.Г. Баранова. – М.: Высшая школа, 1971. – 278с.: ил.
Унифицированные методы анализа вод / под ред. Ю.Ю. Лурье. – М.: Химия, 1971. 248с.
Харьковская, Н.Л. Анализ воды из природных источников / Н.Л. Харьковская, З.Г. Алексеева // Химия в школе. 1997. №3. С. 61-63.
Чен, Т.Х. Методика определения общей жёсткости воды / Т.Х. Чен, Е.А. Алфёров // Химия в школе. 2000. №5. С. 80-81.
Щетинская, О.С. Химия окружающей среды. Методические указания по выполнению лабораторных работ для студентов 5 курса ЕГФ. Брянск: БГПУ, 1999. – 72с.
Приложение 1.Зависимость изменения концентрации ионов кальция и магния в водопроводной и очищенной воде в различных пробах.

Приложение 2.Зависимость степени адсорбции ионов, обуславливающих общую жесткость, от объема воды, пропущенной через фильтр
Приложение 3. Зависимость изменения концентрации катионов кальция в водопроводной и очищенной воде в различных пробах.
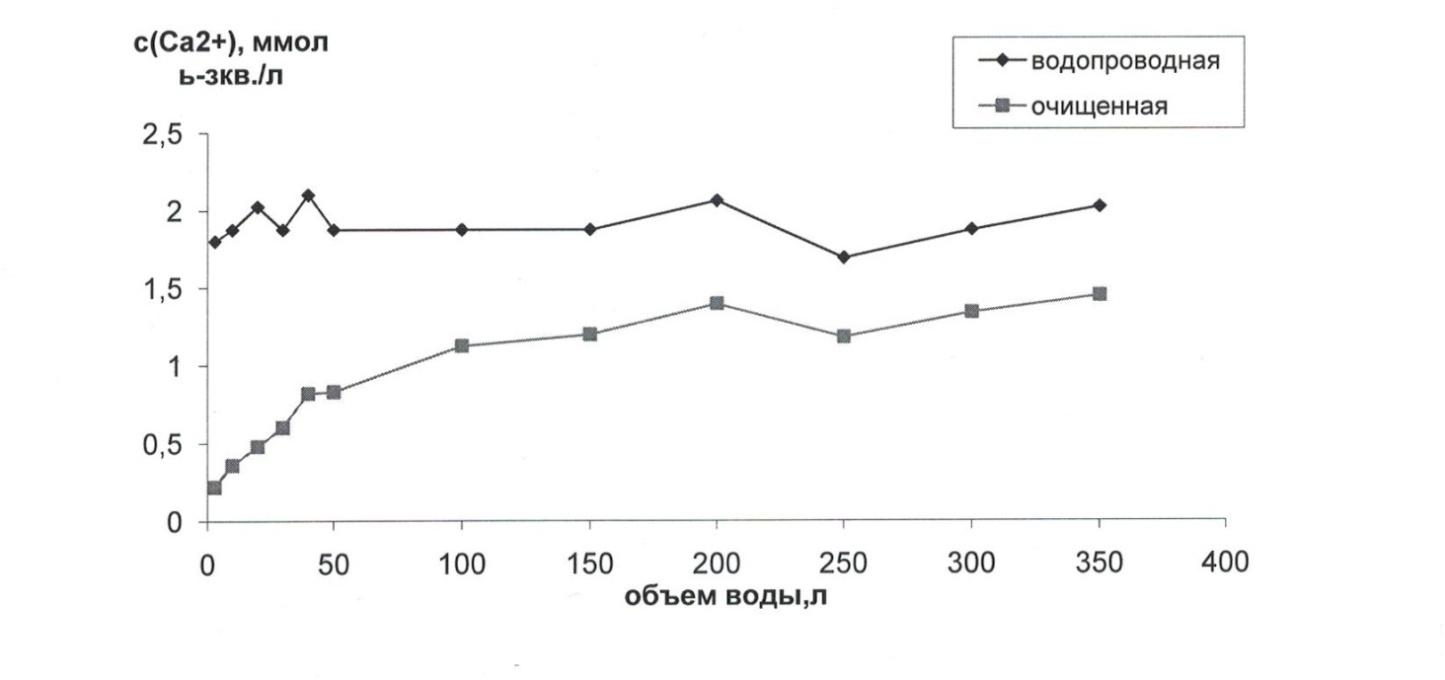
Приложение 4. Зависимость степениадсорбции катионов кальция от объема воды, пропущенной через фильтр.
Приложение 5. Зависимость изменения концентрации катионов магния в водопроводной и очищенной воде в различных пробах

Приложение 6.Зависимость степени адсорбции катионов магния от объема воды, пропущенной через фильтр. 
Приложение 7.Зависимость концентрацииионов, обуславливающих щелочность, в водопроводной и очищенной воде в различных пробах.
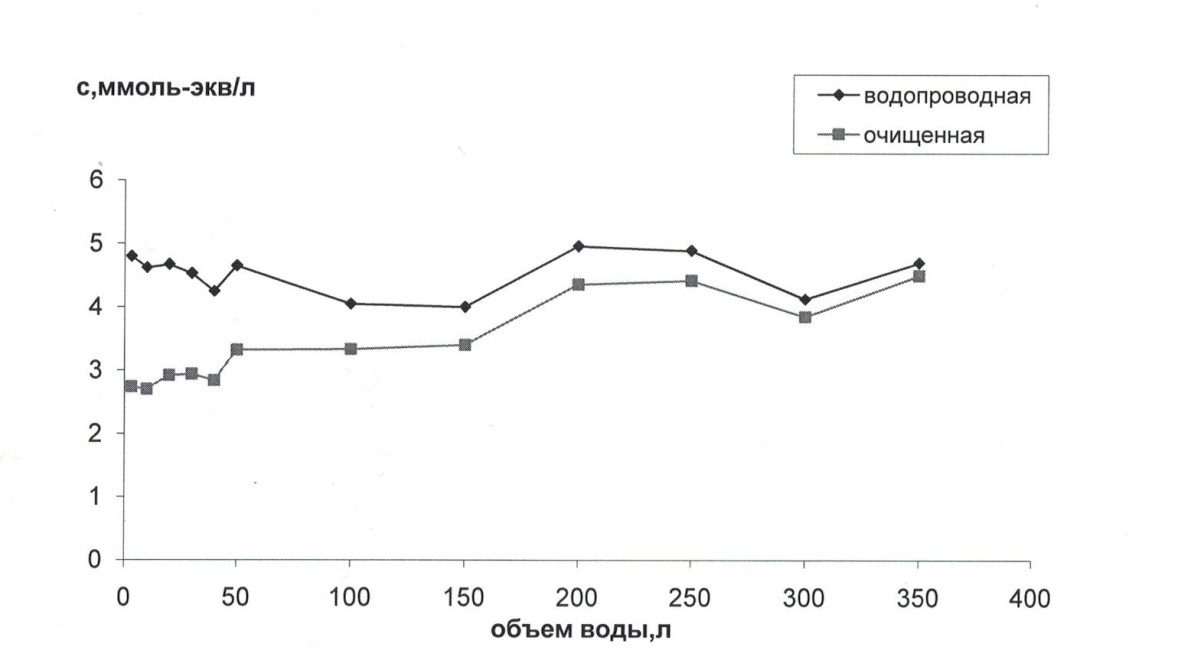
Приложение 8.Зависимость степени адсорбции ионов, обуславливающих щелочность, от объема воды, пропущенной через фильтр







 , где
, где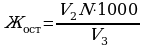 , где
, где , где
, где , где
, где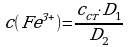 , где
, где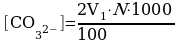 ,
, .
. , где
, где , где
, где ; где
; где

























