
Идеальный газ. Параметры состояния газа. Основное уравнение МКТ идеального газа.
Разработала преподаватель физики ГАПОУ СО «Саратовский техникум отраслевых технологий»
Соляник Стелла Равиловна
2021 г.
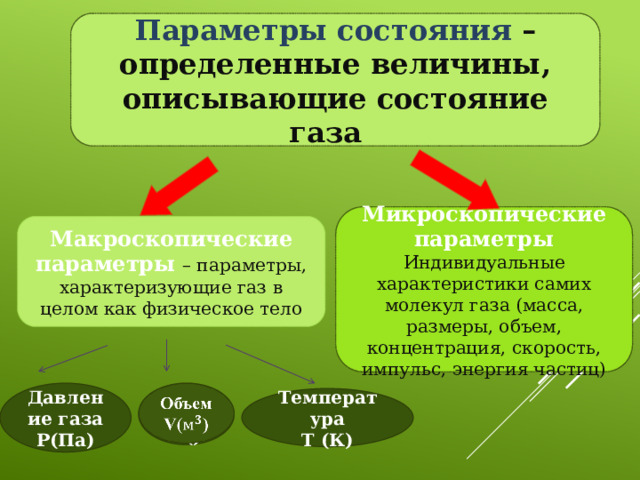
Параметры состояния – определенные величины, описывающие состояние газа
Микроскопические параметры
Индивидуальные характеристики самих молекул газа (масса, размеры, объем, концентрация, скорость, импульс, энергия частиц)
Макроскопические параметры – параметры, характеризующие газ в целом как физическое тело
Давление газа
Объем
P(Па)
V()
Температура
Т (К)

Макроскопические – параметры, которые можно измерить с помощью приборов.
Микроскопические – параметры, которые измеряются косвенным путем.

Идеальный газ – это такой газ, в котором можно пренебречь размерами молекул и силами межмолекулярного взаимодействия, причем, взаимодействие молекул носит характер абсолютно упругого удара
Идеальный газ – физическая модель реального газа
Воздух при нормальных условиях можно приближенно считать идеальным газом
Атмосферное давление 101325 Па = Па=
= 760 мм рт. ст. .
Температура воздуха 273,15 K = 0° C.

Реальный газ
Идеальный газ
(модель)
1 . Совокупность большого числа молекул, размерами которых можно пренебречь (принимают молекулы за материальные точки).
1. Молекулы реального газа не являются точечными образованиями, диаметры молекул лишь в десятки раз меньше расстояний между молекулами.
2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически ( все направления движения молекул равноправны ) .
2. Молекулы не взаимодействуют по законам упругих столкновений .
3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают.
4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной.
5. Все соударения молекул являются абсолютно упругими

Свойства идеального газа
- объём частицы газа равен нулю (т. е. диаметр молекулы пренебрежимо мал по сравнению со средним расстоянием между ними);
- импульс передается только при соударениях (т. е. силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях;
- суммарная энергия частиц газа постоянна (т. е. нет передачи энергии за счет передачи тепла или излучением);
- время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями;
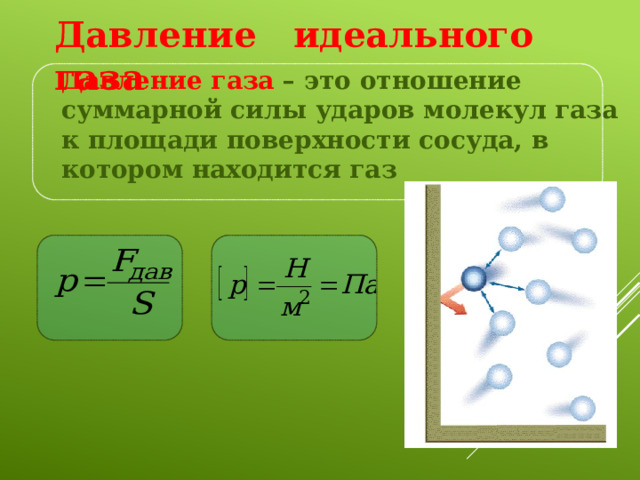
Давление идеального газа
Давление газа – это отношение суммарной силы ударов молекул газа к площади поверхности сосуда, в котором находится газ
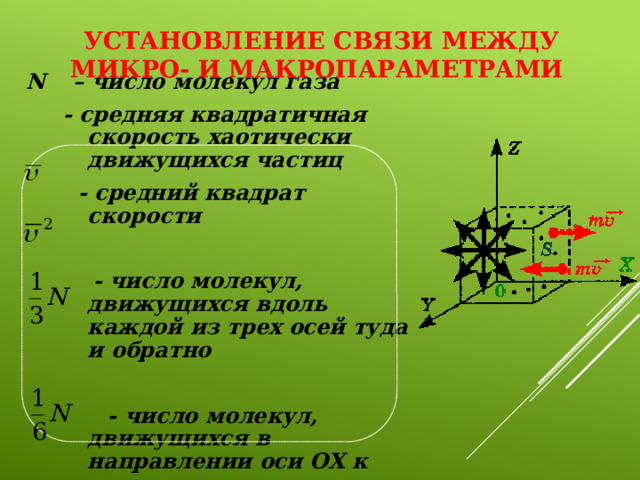
Установление связи между микро- и макропараметрами
N – число молекул газа
- средняя квадратичная скорость хаотически движущихся частиц
- средний квадрат скорости
- число молекул, движущихся вдоль каждой из трех осей туда и обратно
- число молекул, движущихся в направлении оси ОХ к стенке

Изменение импульса для каждой молекулы
⟹
По III закону Ньютона стенка сосуда получит импульс после соударения с одной молекулой:
Импульс стенки при ударе всех молекул
Изменение импульса стенки
![Основное уравнение МКТ идеального газа. Масса Средний квадрат скорости движения молекул [м/с] молекулы [кг] Концентрация молекул [ ] Давление газа [Па]](https://fsd.multiurok.ru/html/2021/09/23/s_614c2aba06c62/img9.jpg)
Основное уравнение МКТ идеального газа.
Масса
Средний квадрат скорости движения молекул [м/с]
молекулы [кг]
Концентрация
молекул [ ]
Давление газа [Па]
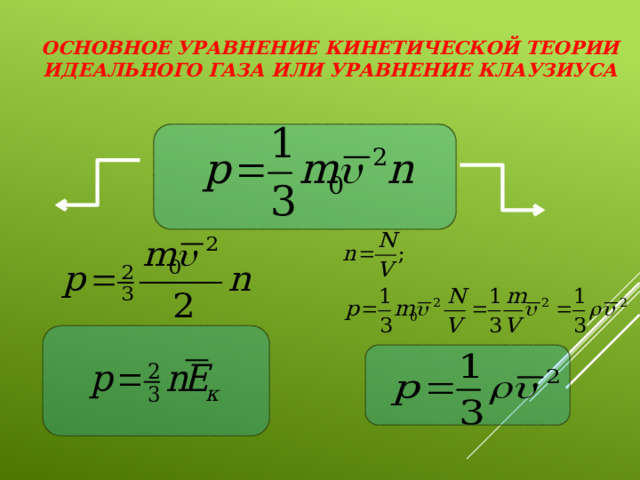
Основное уравнение кинетической теории идеального газа или уравнение Клаузиуса

Закон Дальтона
Давление смеси газов равно сумме их парциальных давлений этих газов
Парциальное давление газа – давление,
которое бы оказывал газ на стенки сосуда,
находясь в нем один
Если в сосуде содержится несколько газов, то каждый газ занимает объем, равный объему сосуда, и все газы имеют одинаковую температуру
















![Основное уравнение МКТ идеального газа. Масса Средний квадрат скорости движения молекул [м/с] молекулы [кг] Концентрация молекул [ ] Давление газа [Па]](https://fsd.multiurok.ru/html/2021/09/23/s_614c2aba06c62/img9.jpg)





















