Галогендер

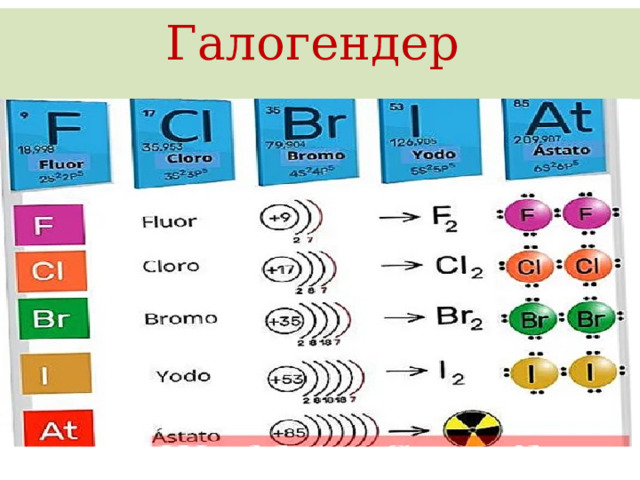
- Галогендер («туз пайда кылуучу») деген маанини билдирет, аларга VII A группанын элементтери: F, Cl, Br, I, At кирет.
- Фтор (F) – эң күчтүү окистендиргич, валенттүүлүгү 1 ге, окистенүү даражасы – 1 ге барабар
- Башка галогендер окистендиргич да калыбына–келтиргич да боло алышат.
- Хлор (Cl) – VII A групапын элементтеринин өкүлү – терс электрлүүлүгү 3,0 барабар болгон жана сырткы электрондук катмарында 7 электрону бар күчтүү окистендиргич. Ошондуктан, хлор бирикмелеринде 1,3,5,7 деген валенттүүлүктү көрсөтөт. Хлор 1774–жылы швед окумуштуусу Шееле тарабынан ачылган . Жер шарында таралышы боюнча он биринчи орунда турат. Ал деңиз сууларынын, өсүмдүктөрдүн хлорофиллинин, жаныбарлардын тканында – кандын плазмасынын жана карын зилинин курамында болот. Жер кыртышынын 0,05% түзөт.


Фтор
- Фтор (латын тилинен Fluorum), Д. И. Менделеев мезгилдик системасы 2-мезгилинин VIIА группа элементи, галогендерге кирет. 9, ат . м. 18,9984. Молекуласы 2 атомдуу. Табигый фтор туруктуу бир изотоптон турат 19F. Жасалма ыкмада алынган 5 радиоактивдүү изотобу бар. Атомунун коваленттик радиусу F + 1,33 ; иондошуу энергиясы: F0 ® F + 401,7 ккал / г ×атом. Фтор жер кыртышында массасы боюнча 6,6×10-2 % түзөт.
- Негизги минералы – плавик шпаты же флюорит – CaF2. Ошондой эле жаратылыштагы фосфат – фтораппатитте 3Ca3(PO4)3×СаF2 (3,3 %) жана криолитте Na3AlF6 – 54,3 % кездешет. Андан сырткары фтор бирикмелери жаратылыш сууларында, өсүмдүк менен жаныбар организминде да кездешет.

Фтордун ачылышы эң татаал ачылыштардын бири болгон. Француз химиктери Жозеф Гей–Люссак, Луи Тенар жана англиялык химик Гемфри Дэви фтордуу суутек менен ууланып, олуттуу күйүккɵ кабыл болушкан. Фторду анын бирикмелеринен электролиз жолу менен алууга аракет кылган француз химиги Эдмон Фреми жана англиялык электрохимик Георг Гор ден–соолуктарына зыян келтиришкен .
1886–жылы гана француз химиги Анри Муассан фторду оңой ала алган. Муассан фтордуу суутектин HF жана калийдин гидродифторидинин (KHF 2 ) суюк аралашмасы электролизден кийин, платина идишке, аноддо кескин жыттуу, ачык–жашыл түстɵгү газдын бɵлүнүп чыкканын кокусунан байкап калган. 1906-жылы Муассанга химия боюнча «кɵптɵгɵн изилдɵɵ иштерин жүргүзгɵндүгү-фторду алгандыгы жана анын аты менен лабораторияда жана ɵндүрүштɵ электр мештерин практикага киргизгендиги үчүн» Нобель сыйлыгы ыйгарылган.

Хлор
- Хлор (Cl 2 ) – сары–жашыл түстөгү уулуу газ, башка заттар менен реакцияга кубаттуу кирет, абадан 2,5 эсе оор. Суутек менен реакциялашканда хлордуу суутекти пайда кылат, хлордуу суутек сууда эригенде туз кислотасы (HCl) алынат.
- Жаратылышта хлор таш тузунун,
- галиттин – ( NaCl , сильвиниттин – ( KCl • NaCl ),
- карнаилиттин – ( KCl • MgCl • H 2 O ),
- каиниттин – ( KCl • MgSO 4 • H 2 O ) курамында кездешет.
- Хлор күкүрт, фосфор жана натрий менен реакцияга кирет.

Хлордун алынышы, колдонулушу
- Өнөр жайда хлор кайнатма туздун NaCl концентарцияланган эритмесин электролиздөө жолу менен алынат: 2NaCl 2Na + Cl 2 ↑
- Адамдын организминде 200 граммга чейинки өлчөмдө натрий хлориди бар.
- Туз кислотасы металлдардын үстүнкү катмарын тазалоо жана жасалгалоо иштеринде, тамак–аш өнөр жайында, медицинада колдонулат.
- Хлор – органикалык бирикмелерди алуу үчун сырье катары колдонулат.

Туз кислотасы
Хлордуу суутек (туз) кислотасы башка кислоталар сыяктуу эле металлдар, негиздик оксиддер жана туздар менен реакцияга кирет. Хлор ичүүчү сууларды тазалоодо, ткандарды, кагаздарды агартууда жана хлор акиташын CaCl(OСl) өндүрүүдө колдонулат.

Бир жолу англиялык химик Гемфри Дэви , идишке ис газы– түссүз жана жытсыз зат менен толуп калгандыгын унутуп, бул идишке кийинки күндɵгү тажрыйбага даярдалган хлорду толтура баштаган.Оозу жабык идиш лабораториялык столдо, терезенин жанында калган. Күн ачык эле. Эртеси эртең менен Дэви идиштеги хлордун саргыч–жашыл түсүнүн ɵзгɵргɵндүгүн байкаган.
Идишти ачканда, окумуштуу ɵзгɵчɵ жытты,алманын, чɵптүн жана жалбырактын чириндилеринин жытындай экендигин сезген.Дэви идиштеги затты изилдеп, газ абалындагы жаңы заттын пайда болгондугун аныктаган. Ал аны «фосген» деп атаган, грек тилинен которгондо, “жарыкты алып жүрүүчү” деген маанини түшүндүргɵн. Мына ошентип, 1811–жылы Биринчи Дүйнɵлүк согушта кеңири пайдаланылган ууландыруучу зат ачылган.

Йод
- Йод (I 2 ) – кочкул түстөгү кристаллдар. Ысытканда суюктукка айланбай туруп эле бууланат. Иоддун бул касиети ( кургак айдоо же сублимация деп аталат).

1811–жылы француз химик–технологу жана фармацевт Бернар Куртуа йодду ачкан. Түшкү тамактануу учурунда дайыма жакшы кɵргɵн мышыгы анын ийнине отуруп алган.
Куртуанын лабораторияда тамактанган учуру кɵп болгон.
Күндɵрдүн биринде түшкү тамактануу учурунда мышык бир нерседен чочуп кеткендиктен, жерге секирип түшɵт. Ал кокусунан лабораториялык столдо турган бɵтɵлкɵнү кулатып кетет. Бɵтɵлкɵнүн бирɵɵнɵ Куртуа балырлардын күлүнɵн жасалган этил спиртинин суспензиясын (натрий иодиди), ал эми экинчисине концентрацияланган күкүрт кислотасын куюп койгон.
Бɵтɵлкɵлɵр талкаланып, суюктуктар аралашып калган. Жерден кочкул–кɵк түстɵгү буулар жогору карай кɵтɵрүлгɵн жана металлдык жалтырактыкка ээ, кескин жыттуу, кара–кочкул түстɵгү кичинекей кристаллдар топтоло баштаган. Бул жаңы ачылган элемент–йод болгон.

Галогендердин касиеттери
- Фтор эң күчтүү окистендиргич, кремнийдин бирикмелери менен реакцияга кирет.
- Астат – радиоактивдүү, аз изилденген туруксуз изотоп.
- Бардык галогенсуутектер газ абалында болушат, сууда жакшы эришет.
- Галогенсуутектердин суудагы эритмелери кислота болуп саналат.
- Хлор менен бир аз эле дем алса ал дем алуу органдарынын жабыркоосуна жана жөтөлгө алып келет.
- 1 көлөм сууда 2,5 көлөм хлор эрип, хлор суусун пайда кылат (7,9 г/л). Cl 2 + H 2 O HCl + HClO
- Суюлтулган хлор 600кПа басым астында болоттон жасалган баллондордо сакталат. Лабораторияда хлор калий перманганатына туз кислотасын таасир этип, ысытуунун натыйжасында алынат:
- 2KMnO 4 +16HCl 2MnCl 2 + 2KCl + 8H 2 O + 5Cl 2 ↑

Химиялык касиеттери
Фтор хлорду,бромду жана иодду алардын туздарынан жана кислоталарынан сүрүп чыгат. Хлор бромду,иодду, бром иодду гана сүрүп чыгарат. (Мисалы: Cl 2 +2KI 2KCl +I 2 ↓), б.а. терс электрлүүлүгү күчтүү элементтер начарыраактарын алардын кислоталарынын жана туздарынын эритмелеринен сүрүп чыгарат.

Бром
Бром (латынча Bromum), Br – элементтердин мезгилдик системасынын VII тобунан орун алган элемент, галогендерге кирет. 1826-ж. франциялык химик А. Ж. Балар ачкан. Жаратылышта 2 туруктуу изотоптон 79 Br, 81 Br турат. Жер кыртышында 1,6 10 –4 %ти түзөт. Ал кызыл-күрөң түстөгү, жагымсыз жыты бар, оор суюктук. Кайноо t 58,78°C, балкып эрүү t 7° С. Бромдуу туздар (KBr, NaBr, MgBr 2 ) түрүндө көл, деңиз, нефть сууларында жана суу өсүмдүктөрүнүн курамында кездешет. Спиртте, эфирде, бензолдо, хлороформдо жакшы, сууда аз эрийт. Бромдун 3%түү эритмеси бромдуу суу деп аталат. Химиялык активдүүлүгү боюнча хлор менен иоддун ортосунда турат. Иодду бирикмелеринен сүрүп чыгарат. Ал эми бромду анын бирикмелеринен хлор сүрүп чыгат. Бирикмелеринде валенттүүлүгү –1ден+7ге чейин. Көпчүлүк элементтер менен реакцияга активдүү кирет.

Бром
Көмүртек, азот, кычкылтек менен түздөн-түз кошулбайт, ошондуктан алардын бирикмелери кыйыр жолдор менен алынат. Суутек менен ысытканда гана реакцияга кирип, бромдуу суутекти пайда кылат. Анын суудагы эритмеси бромдуу суутек кислотасы. Бул кислотанын туздары бромиддер деп аталат. Бром кислотасынын туздары броматтар, түссүз кристаллдар, жогорку температурада кычкылтекти бөлүп чыгаруу менен ажырайт. Бром кислотасы жана анын туздары күчтүү окистендиргич касиетке ээ болуп, эркин бромго чейин калыбына келет. Деңиз сууларынан, суу өсүмдүктөрүнөн, ошондой эле калийдин бромдуу бирикмелеринен химиялык жол менен алынат. Бром органикалык синтезде, анализдик химияда жана окистендиргич катары колдонулат.







































