| МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное АВТОНОМНОЕ образовательное учреждение высшего образования «Национальный исследовательский ядерный университет «МИФИ» |
| Московский областной политехнический колледж– филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ» (МОПК НИЯУ МИФИ) |
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ БД.06
Естествознание. Химия
для специальностей
13.02.11 ТЭО; 08.02.01 СЭЗ; 22.02.06 СП; 15.02.08 ТМ.
Разработал преподаватель ________________ И.А.Бусарова
(подпись)
г. Электросталь, 2022г
CОДЕРЖАНИЕ
1.Введение..........................................................................................................3
2.Основные сведения о работе в химической лаборатории..........................4
2.1.Порядок выполнения лабораторных работ...............................................4
2.2. Меры предосторожности при выполнении лабораторных работ..........4
2.3. Необходимые меры при несчастных случаях..........................................4
3.Лабораторные работы....................................................................................5
4.Информационное обеспечение обучения…………………………………18
1.Введение
Настоящий практикум предназначен для использования учащимися нехимических специальностей при домашней подготовке к выполнению лабораторных работ и в процессе выполнения их в лаборатории.
Лабораторные работы знакомят со способами получения органических и неорганических веществ и с их свойствами.
Базовая дисциплина БД.06. "Естествознание. Химия" способствует формированию следующих компетенций:
ОК 01. Выбирать способы решения задач профессиональной деятельности применительно к различным аспектам;
ОК 02. Осуществлять поиск, анализ и интерпретацию информации, необходимой для выполнения задач профессиональной деятельности;
ОК 03.Планировать и реализовывать собственное профессиональное и личностное развитие;
ОК 04.Работать в коллективе и команде, эффективно взаимодействовать с коллегами, руководством, клиентами;
ОК 05.Осуществлять устную и письменную коммуникацию на государственном языке Российской Федерации с учетом особенностей социального и культурного контекста;
ОК 06.Проявлять гражданско-патриотическую позицию, демонстрировать осознанное поведение на основе традиционных общечеловеческих ценностей;
ОК 07.Содействовать сохранению окружающей среды, ресурсосбережению, эффективно действовать в чрезвычайных ситуациях;
ОК 09. Использовать информационные технологии в профессиональной деятельности.
2.Основные сведения о работе в химической
лаборатории.
2.1 Порядок выполнения лабораторных работ.
При проведении лабораторных работ необходимо выполнить следующее:
1. Внимательно ознакомиться с содержанием темы практического занятия.
2. Выполнять каждую работу индивидуально, на своем рабочем месте.
3. Внимательно следить за ходом процесса, не отходя от рабочего места во время работы.
4. Не держать на лабораторном столе вещи, не имеющие отношения к данной лабораторной работе, соблюдать на рабочем месте образцовую чистоту и порядок.
5. Строго соблюдать правила техники безопасности.
2.2 Меры предосторожности при выполнении работ.
1. При выполнении каждого опыта сначала необходимо внимательно ознакомиться с описанием постановки опыта, а затем приступать к его выполнению.
2. Все опыты с ядовитыми и довольно пахнущими веществами проводить под тягой.
3. При нагревании пробирок следить за направлением их отверстий, не направлять отверстия пробирок на себя, работающих рядом или напротив.
4. Для определения запаха какого-либо газа или другого вещества не наклоняться над сосудом, не подносить его к лицу и не вдыхать полной грудью, а осторожно направить к себе поток воздуха от сосуда легким движением руки.
5. Особую осторожность следует проявлять при работе с газами, дающими взрывчатые смеси с воздухом (метан, этилен, ацетилен), а так же при работе с крепкими (концентрированными) кислотами и щелочами.
2.3 Необходимые меры при несчастных случаях.
1. При попадании на кожу кислоты тщательно промывают пораженный участок водой и нейтрализуют раствором бикарбоната.
2. При попадании на кожу щелочи промывают пораженный участок водой, а затем нейтрализуют разбавленной уксусной или лимонной кислотой.
3. Если на кожу попал бром, фенол и другие вещества, раздражающие кожный покров, то смывают органическими растворителями (спирт, эфир).
4. При отравлении парами брома, хлора вдыхают ртом пары разбавленного нашатырного спирта.
5. При ожоге промывают обожженные места 10%-ным раствором марганцовокислого калия.
6. При возникновении пожара, сохраняя спокойствие, выключают во всей лаборатории газ, электронагревательные приборы, засыпают песком или покрывают войлочным одеялом очаг пожара. Большое пламя гасят огнетушителями.
3.Лаборатнорные работы.
Лабораторная работа №1
Основное классы неорганических соединений .
Реактивы: штатив с пробирками, растворы: нитрата свинца, йодида калия, серной и соляной кислот, хлорида бария, карбоната натрия, гидроксида натрия, сульфата хрома.
Опыт №1. Получение солей сульфата свинца и йодида свинца.
Пользуясь имеющимися растворами солей получите: сульфат и йодид свинца.
Проделайте реакции. Отметьте наблюдения. Сделайте вывод. Уравнения реакций запишите в молекулярной и ионной формах.
Pb(NO3)2 + H2 SO4 → PbSO₄↓ + HNO₃
Pb(NO3)2 + KI → PbI₂↓ + KNO₃
Опыт №2. Получение гидроксида хрома и изучение его свойств.
Поместите в пробирку 1-2 мл раствора сульфата хрома и добавьте столько же раствора щелочи до образования гидроксида хрома. Отметьте наблюдения.
Полученный осадок вместе с раствором разделите в две пробирки. В одну из них прилейте несколько капель раствора серной кислоты, в другую - гидроксида натрия до растворения осадка. Отметьте наблюдения.
Напишите уравнения реакций в молекулярной ионной формах:
а) образование гидроксида хрома
Cr2(SO4)3 + NaOH → Cr(OH)₃↓ + +Na₂SO₄
б) взаимодействие гидроксида хрома с соляной кислотой и с избытком гидроксида натрия.
Cr(OH)₃+ HCl → CrCl₃ + H₂O
Cr(OH)₃+ NaOH → Na₃[Cr(OH)₆]
Сделайте вывод о свойствах гидроксида хрома.
Опыт №3. Случаи течения реакций до конца.
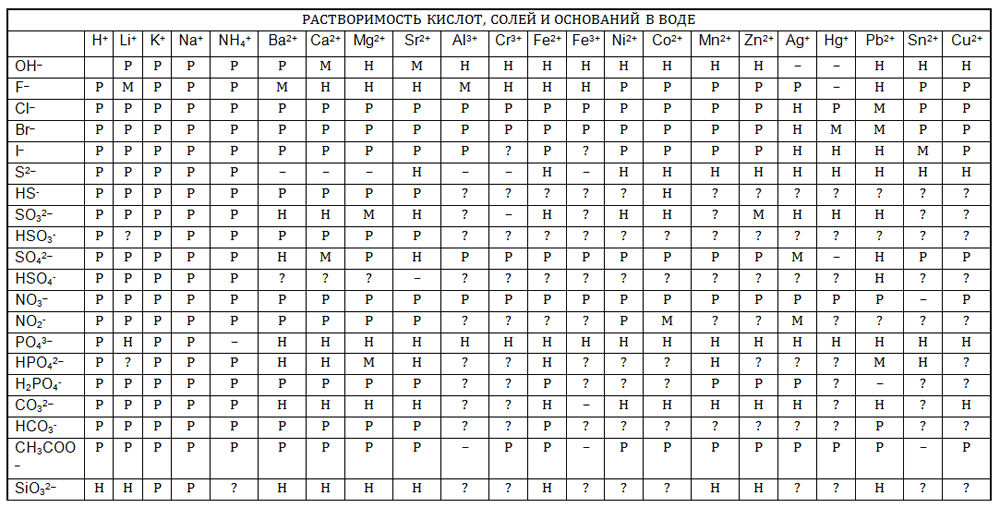
Пользуясь таблицей растворимости солей и оснований в воде, подберите из имеющихся растворов солей, кислот, щелочей такие растворы которые при взаимодействии между собой привели бы:
а) к образованию осадка
BaCl2 + H2SO4 → BaSO₄↓ + HCl
б) к выделению газообразного вещества
Na2 CО3 + HCl → NaCl + CO₂↑ + H₂O
в) к образованию малодиссоциирующего вещества.
NaOH + H2SO4 → Na₂SO₄ + H₂O
или
NaOH + HCl → NaCl + H₂O
Проделайте эти реакции. Отметьте наблюдения. Напишите уравнения химических реакций в молекулярной и ионной формах.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1. Получение солей сульфата свинца и йодида свинца 2. Получение гидроксида хрома и изучение его свойств. 3. Случаи течения реакций до конца. |
|
|
|
Лабораторная работа №2
Соединения марганца и хрома
Реактивы: штатив с пробирками, спички, растворы: сульфата марганца (Ⅱ), гидроксида натрия, перманганата калия, сульфата натрия, серной кислоты, дихромата калия, дихромата аммония (кристаллический ).
Опыт №1. Получение гидроксида марганца (Ⅱ) и окисление его кислородом воздуха.
В пробирку с раствором соли двухвалентного марганца прилить раствор щелочи, Каков цвет полученного осадка гидроксида марганца(Ⅱ) ?
Отметить побурение осадка вследствие окисления двухвалентного марганца до четырехвалентного состояния.
Составьте уравнения реакции. Сделайте вывод.
MnSO4 + NaOH → Na₂SO₄ + Mn(OH)₂↓
Mn(OH)2 + O2 → Mn(OH)₄↓
Опыт №2. Взаимодействие перманганата калия с сульфитом натрия в кислой и нейтральной cредах.
В 2 пробирки налить 1-2 мл раствора перманганата калия. В одну пробирку добавить разбавленную серную кислоту, а в другую - столько же воды. В обе пробирки прилить раствор сульфита натрия. Отметить изменение первоначальной окраски раствора перманганата калия в каждом случае.
KMnO4 + H2SO4 + Na2 SO3 → MnSO₄ + K₂SO₄ + Na₂SO₄ + H₂O
KMnO₄ + H₂O + Na2 SO3 → MnO₂ + KOH + Na₂SO₄
Составьте электронные схемы и подберите коэффициенты.
Сделайте вывод.
Опыт №3. Окислительные свойства солей шестивалентного хрома.
К 2-3 мл дихромата калия прибавить разбавленной серной кислоты и раствора сульфита натрия. Следите за изменением окраски от оранжевой
(Cr2 O7)²⁻до зеленой (Cr)³⁺.
K2Cr2O7 + Na2 SO3+ H2SO4 → Cr₂(SO₄)₃ + K₂SO₄ + Na₂SO₄ + H₂O
Составьте электронную схему и подберите коэффициенты.
Небольшое количество кристаллического дихромата аммония поместить на металлический поднос и поджечь. Следить за выделением газов и изменением окраски от оранжевой до зеленой.
Составьте электронную схему и подберите коэффициенты. Сделайте вывод.
(NH4)2 Cr2O7 →(нагреть) Cr2 O3 + N2↑ + H₂O↑
Проделайте эти реакции. Отметьте наблюдения. Напишите уравнения химических реакций.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Получение гидроксида марганца (Ⅱ) и окисление его кислородом воздуха. 2.Взаимодействие перманганата калия с сульфитом натрия в кислой и нейтральной cредах. 3.Окислительные свойства шестивалентного хрома. |
|
|
|
Лабораторная работа №3
Соединения железа.
Реактивы: штатив с пробирками, растворы: сульфата железа, хлорида железа (Ⅲ), гидроксида натрия, серной кислоты, перманганата калия, желтой кровяной соли, красной кровяной соли, роданида калия.
Опыт №1. Получение гидроксида железа (Ⅱ), превращение его в гидроксид железа(Ⅲ).
В пробирке к 1-2 мл раствора сульфата железа (Ⅱ) добавить такой же объем раствора гидроксида натрия. Отметить образование белого осадка, переходящего в зеленый, а затем в бурый.
Напишите уравнения взаимодействия сульфата железа (Ⅱ) с гидроксидом натрия и окисления гидроксида железа(Ⅱ) на воздухе.
FeSO4 + NaOH → Fe(OH)₂↓ + NaSO₄
Fe(OH)2 + O2 + H2O→ Fe(OH)3↓
Сделайте вывод.
Опыт №2. Получение гидроксида железа (Ⅲ) и изучение его основных свойств.
В пробирку к 1-2 мл раствора хлорида железа (Ⅲ) прилейте 1-2 капли раствора гидроксида натрия. Наблюдайте образование бурого осадка. К полученному гидроксиду железа (Ⅲ) прилейте несколько капель серной кислоты до растворения осадка. Запишите наблюдения.
Напишите уравнения реакций в молекулярной и ионной формах:
FeCl3 + NaOH → Fe(OH)₃↓ + NaCl
Fe(OH)3 + H2SO4 → Fe(SO₄)₃ + H₂O
Сделайте вывод.
Опыт №3. Окисление сульфата железа (Ⅱ) перманганатом калия в кислой среде.
В пробирку с 2-3 мл раствора перманганата калия добавьте 2-3 капли раствора серной кислоты и 4-5 капель раствора сульфата железа(Ⅱ). Наблюдайте изменение окраски.
Составьте электронную схему, подберите коэффициенты.
KMnO4 + H2SO4 + FeSO4 → MnSO₄ + K₂SO₄ + Fe₂(SO₄)₃ + H₂O
Сделайте вывод.
Опыт №4. Качественные реакции на соли железа (Ⅱ) и железа(Ⅲ).
Ионы двухвалентного железа дают с гексацианоферратом (Ⅲ) калия (красной кровяной солью) характерный темно-синий осадок гексацианоферрат(Ⅲ) железа(Ⅱ) (турнбулеву синь). Ионы трехвалентного железа с гексацианоферратом(Ⅱ) калия ( желтой кровяной солью) образуют сине-зеленый осадок гексацианоферрат(Ⅱ) железа(Ⅲ) (берлинскую лазурь), а с тоцианатом калия или аммония (роданидом калия или аммония) – кроваво-красное окрашивание тоцианата железа(Ⅲ) (роданида железа(Ⅲ)).С помощью указанных реакций можно определить присутствие ничтожных количеств ионов железа(Ⅱ) и железа(Ⅲ) в растворе. Проделать данные реакции, отметить наблюдения, записать уравнения реакций в молекулярной и ионной формах:
FeSO4 + K3[Fe(CN)6] → Fe₃[Fe(CN)₆]2↓ + K₂SO₄
FeCl3 + K4[Fe(CN)6] → Fe₄[Fe(CN)₆]₃↓ + KCl
FeCl3 + KCNS → Fe(CNS)₃ + KCl
Сделайте вывод.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Получение гидроксида железа(Ⅱ), превращение его в гидроксид железа(Ⅲ). 2.Получение гидроксида железа(Ⅲ)и изучение его основных свойств. 3. Окисление сульфата железа (Ⅱ) перманганатом калия в кислой среде. 4. Качественные реакции на соли железа(Ⅱ)и железа(Ⅲ).
|
|
|
|
Лабораторная работа №4
Спирты. Фенолы. Альдегиды.
Реактивы: штатив с пробирками, спиртовка, медная проволока, этиловый спирт (этанол), глицерин, растворы: сульфата меди, гидроксида натрия, нитрата серебра, гидроксида аммония, муравьиного альдегида (метаналь, формальдегид), хлорида железа(Ⅲ).
Опыт №1. Окисление спирта в альдегид .
Налейте в пробирку 1 мл этилового спирта. Сильно раскалите кусочек медной проволоки в пламени спиртовки до образования черного налета. Не давая меди остыть, отпустите ее в пробирку со спиртом. Быстро понюхайте выделившиеся пары, имеющие запах свежих яблок, который указывает на образование уксусного альдегида. Что происходит с медью ?
Написать уравнение реакции.
Cu + O2 →(нагреть) CuO
C2H5OH + CuO → CH₃ – СОН + Cu + H₂O
Сделайте вывод.
Опыт №2. Получение глицерата меди.
Налейте в пробирку немного раствора сульфата меди и добавьте раствора гидроксида натрия. К образовавшемуся осадку в этой пробирке добавьте 0,5 мл глицерина и тщательно перемешайте содержимое. Отметьте наблюдения. Написать уравнения реакций.
CuSO4 + NaOH → Cu(OH)₂↓ + Na₂SO₄
СН2 – OH OH ↘ СН2 – OH ↘
| Cu → | Cu
СН – OH + OH ↗ СН – OH ↗ + H2 O
| |
СН2 – OH СН2 – OH
Сделайте вывод.
Опыт №3. Взаимодействие фенола с хлоридом железа (Ⅲ).
Налейте в пробирку 1мл концентрированного раствора фенола и добавьте 1-2 капли раствора хлорида железа (Ⅲ). Отметьте наблюдения.
Напишите уравнения реакции.
С6 H5OH + FeCl3 → С6 H5 OFeCl2 + HCl
Сделайте вывод.
Опыт №4: Окисление альдегидов.
Окисление формальдегида (формалина) будем проводить аммиачным раствором оксида серебра (реакция «серебряного зеркала»). Реакция «серебряного зеркала» осуществима только в совершенно чистой пробирке. Так как оксид серебра не растворяется в воде, то для получения аммиачного раствора оксида серебра используют реакцию между нитратом серебра и гидроксидом аммония (водным раствором аммиака). В чистую пробирку налейте 5-6 капель раствора нитрата серебра, затем прибавляйте по каплям гидроксид аммония, выпадает осадок гидроксида серебра, прибавляйте гидроксид аммония до растворения выпавшего осадка. К полученному раствору, вращая пробирку, по стенкам прибавьте немного формальдегида (формалина). Полученную смесь быстро и осторожно слегка нагреть (до кипения не доводить). Как только заметите, что содержимое пробирки побурело и на стенках начал образовываться зеркальный слой серебра, прекратите нагревание.
Отметьте наблюдения. Напишите уравнения реакций.
AgNO3 + NH4OH → AgOH↓ + NH₄NO₃
AgOH → Ag₂O + H₂O
H – COH + Ag2O →(нагреть) Ag↓ + HCOOH
Сделайте вывод.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Окисление спирта в альдегид.
2.Получение глицерата меди 3.Взаимодействие фенола с хлоридом железа (Ⅲ).
4. Окисление альдегидов. |
|
|
|
Лабораторная работа №5
Углеводы.
Реактивы: штатив с пробирками, спиртовка, растворы: глюкозы, нитрата серебра, гидроксида аммония, сульфата меди, гидроксида натрия, крахмала, йода.
Опыт №1. Окисление глюкозы аммиачным раствором оксида серебра.
В чистую пробирку налейте немного раствора глюкозы и в 2 раза меньше аммиачного раствора оксида серебра (кто забыл, как он готовиться, читайте опыт 4 в лабораторной работе №4 «Спирты. Фенолы. Альдегиды.»).
Пробирку слегка нагрейте. Как только заметите на стенках образование зеркального налета, нагревание прекратите. Отметьте наблюдения. Напишите уравнения реакции «серебряного зеркала».
СН2OH – (CHOH)4 – СОН + Ag2O →(нагреть) Ag↓ + СН2OH – (CHOH)4–СООН
Сделайте вывод.
Опыт №2. Окисление глюкозы гидроксидом меди (Ⅱ) при нагревании.
В пробирку налейте 1мл раствора глюкозы, в 2 раза меньше гидроксида меди и столько же раствора гидроксида натрия. Все тщательно перемещайте, осадок раствориться. Затем пробирку с содержимым нагрейте до образования кирпично-красного осадка оксида меди (Ⅰ).
Отметьте наблюдения. Напишите уравнение реакции окисления глюкозы.
СН2OH – (CHOH)4 – СОН + Cu(OH)2 →(нагреть) Cu2O↓ + СН2OH – (CHOH)4–СООН + Н2О
Сделайте вывод.
Опыт №3. Окисление глюкозы гидроксидом меди (Ⅱ) без нагревания.
В пробирку налейте 1мл раствора глюкозы, 0,5мл сульфата меди и 0,5мл гидроксида натрия. Все тщательно перемешайте, осадок раствориться. Какая окраска раствора? Отметьте наблюдения. Напишите уравнения реакции окисления глюкозы.
OH↘
СН2OH – (CHOH)4 – СОН+ Cu → Н2О +
OH↗
+ СН2ОН - СН – CH - (CHOH)2 – СОН
| |
O O
↘ ↙
Cu
Сделайте вывод.
Опыт №4. Реакция крахмала с йодом.
В пробирку налейте немного раствора крахмала в воде (клейстера) и 2-3 капли раствора йода. Отметьте наблюдения. Напишите уравнения реакции.
(C6 H10O5)n + I2 → I₂(C₆H₁₀O₅)n
Сделать вывод.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Окисление глюкозы аммиачным раствором оксида серебра. 2. Окисление глюкозы гидроксидом меди (Ⅱ) при нагревании.
3. Окисление глюкозы гидроксидом меди (Ⅱ) без нагревания. 4. Реакция крахмала с йодом. |
|
|
|
4. Информационное обеспечение обучения
Перечень рекомендуемых учебных изданий, Интернет-ресурсов, дополнительной литературы.
Основные источники:
1. Ерохин Ю.М., Ковалёва И.Б. Химия для профессий и специальностей технического и естественнонаучного профилей: учебник для студ. СПО. - М.: Академия, 2018.
2. Габриелян О.С., Остроумов И.Г. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
3. Габриелян О.С. Химия. 10 класс. Базовый уровень: учебник для общеобразовательных учреждений / О.С. Габриелян – М.: Дрофа, 2018.
4. Габриелян О.С. Химия. 11 класс. Базовый уровень: учебник для общеобразовательных учреждений / О.С. Габриелян – М.: Дрофа, 2018.
Дополнительные источники:
1. Ерохин Ю.М., Химия в вопросах и ответах; учебное пособие / Ю.М.Ерохин.- Москва: Проспект, 2017.
2. Габриелян О.С., Остроумова И.Г., Остроумова Е.Е. и др.. Химия для профессий и специальностей естественно-научного профиля: учебник для студ. учреждений СПО. – М.. 2018.
Интернет-ресурсы:
1.http://him.1september.ru/ - электронная версия газеты «Химия» приложение к «1 сентября»
2..http://www.alhimik.ru/ - АЛХИМИК, электронный журнал для преподавателей и студентов, изучающих химию. Много интересной и полезной информации.
3.http://hemi.wallst.ru/ - Химия. Образовательный сайт.
4.http://.www.edu.var.ru/russian/cources/chem/ - Задачи, химические опыты, словарь химических терминов и многое другое.


























