Просмотр содержимого документа
«Электролиттик диссоциация теориясы»
№ 11 В.В.Терешкова атындагы мектеп-интернаты
Химия мугалими: Кимсанова Максуда
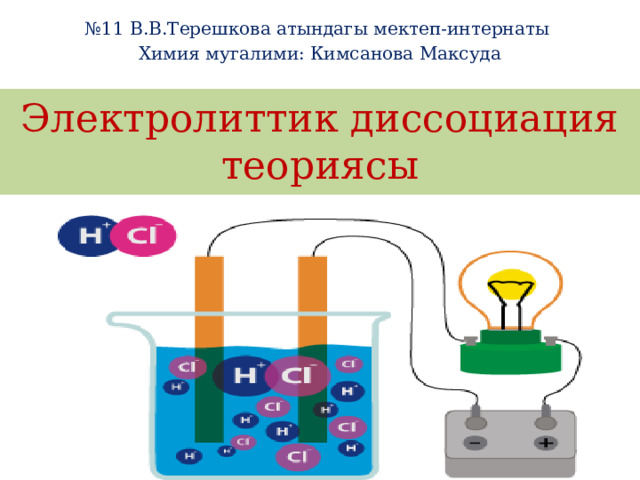
Электролиттик диссоциация теориясы

Сванте Аррениус ар түрдүү типтеги эритмелер аркылуу электр тогунун ɵтүшүн изилдеген. Ал кээ бир заттардын молекулалары сууда эригенде диссоциациялана тургандыгын, б.а. эки же андан кɵп бɵлүкчɵлɵргɵ–иондорго ажырай тургандыгын божомолдогон. «Бирок, ар бир бүтүн молекула электронейтралдуу болсо да, анын бɵлүкчɵлɵрү бир аз электр зарядына ээ болот, ал бɵлүкчɵнүн жаратылышына карата, же оң, же терс болушу мүмкүн. Мисалы, натрий хлоридин (туз) сууда эриткенде, ал оң заряддалган натрийдин атомуна жана терс заряддалган хлордун атомуна ажырайт. Бул заряддалган атомдор, молекуланын активдүү курамдык бɵлүгү катары эритмелерде гана пайда болот жана электр тогунун ɵтүшү үчүн шарт түзɵт. Электр тогу ɵз кезегинде активдүү курамдык бɵлүктɵрдү карама–каршы заряддалган электроддорго багыттайт».
Швед физик–химиги Сванте Август Аррениус Упсаладан алыс эмес жердеги Вейк имениесинде туулган.

Сванте Аррениустун эмгеги
- 1903–ж. гана Аррениуска «химия илимин ɵнүктүрүүдɵ анын электролиттик диссоциация теориясынын ɵзгɵчɵ маанисин таануу максатында» Нобель сыйлыгы ыйгарылган. Швеция королевствосунун Илимдер академиясынын атынан чыккан X.Р.Тернеблад Аррениустун иондор теориясы «математика менен жакындашып», электрохимиянын ɵнүгүшүнɵ жол салгандыгын баса кɵрсɵткɵн. «Аррениустун теориясынын маанилүү натыйжаларынын бири, химия боюнча биринчи Нобель сыйлыгын алган Вант–Гоффтун эмгегин жыйынтыктагандыгы болуп саналат», – деген Тернеблад .

Электролиттер жана электролит эместер
- Кээ бир заттардын эриген же балкыган абалда электр тогун ɵткɵрɵ тургандыгы, ал эми башкалары электр тогун ɵткɵрбɵй тургандыгы белгилүү. Муну биз жɵнɵкɵй эле куралдын жардамы менен байкасак болот.
- Ал электр тогу менен байланыштырылган кɵмүр электроддорунан турат. Чынжырга токтун бар же жок экендигин кɵрсɵтүүчү электр лампочкасы да туташтырылган. Эгерде электродду канттын эритмесине салсак, анда лампочка күйбɵйт. Ал эми электродду натрий хлоридинин эритмесине салсак, ал жарык болуп күйɵт. Эритмелери же балкыган эритиндилери электр тогунун таасири астында иондорго ажыраган заттар электролиттер деп аталат. Эритмелери электр тогунун таасири астында иондорго ажырабаган заттар электролит эместер деп аталат. Электролиттерге кислоталар, негиздер жана бардык туздар кирет, ал эми электролит эместерге кɵпчүлүк органикалык заттар кирет.

Электролиттик диссоциация теориясы
- Электролиттердин эритмелеринин ɵзгɵчɵлүгүн түшүндүрүү максатында, 1887-жылы швед окумуштуусу С. Аррениус электролиттик диссоциация теориясын сунуш кылган.
- Кийинчерээк бул теория атомдордун түзүлүшү жана химиялык байланыштар жɵнүндɵгү окуунун негизинде, окумуштуулар тарабынан ɵнүктүрүлгɵн. Бул теориянын учурдагы мазмуну тɵмɵнкү үч жободо берилген:

Электролиттик диссоциация теориясынын үч жобосу
- 1-жобо. Электролиттер сууда эригенде оң жана терс заряддалган иондорго ажырашат (диссоциацияланат). Иондор атомго караганда туруктуу болгон электрондук абалда болушат.
- Эгерде бир түрдүү атомдон турса, жɵнɵкɵй ион деп аталат (Na + , Mg 2+ , Аl 3+ ж.б.) болушат. Ал эми ар түрдүү атомдон турса, татаал ион деп аталат (NО 3 – , SO 4 2– , РО 4 3– ж.б.).
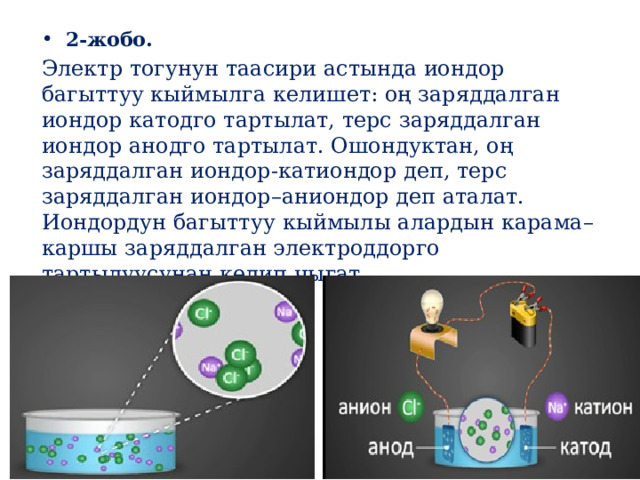
Электр тогунун таасири астында иондор багыттуу кыймылга келишет: оң заряддалган иондор катодго тартылат, терс заряддалган иондор анодго тартылат. Ошондуктан, оң заряддалган иондор-катиондор деп, терс заряддалган иондор–аниондор деп аталат. Иондордун багыттуу кыймылы алардын карама–каршы заряддалган электроддорго тартылуусунан келип чыгат.

Диссоциация – кайталанма процесс: молекулалардын иондорго ажырашы (диссоциация же иондошуу) менен катар эле иондордун биригүүсү (ассоциация же моляризация) жүрүп турат. Ошондуктан, электролиттик диссоциациянын теңдемесинде барабардыктын ордуна карама–каршы багытталган жебелер (стрелка) жазылат.

Электролиттик диссоциациянын механизмин карап кɵрɵлү. Иондук байланыш менен байланышкан заттар жеңил диссоциацияланат, себеби, бул заттар иондордон турат. Алар эригенде, суунун диполу оң жана терс заряддалган иондордун айланасына багыт алат. Иондор менен суунун диполунун ортосунда тартылуу күчү пайда болот. Жыйынтыгында, иондордун ортосундагы байланыш начарлайт да, иондор кристаллдан эритмеге ɵтүшɵт

Бышыктоо
- Электролиттик диссоциация теориясынын негизги жоболору кандай?
- Диссоциация, ассоциация деген эмне?
- Нобель сыйлыгы жөнүндө эмнелерди билесиңер?
- С.Арренистун, И.А.Каблуковдун жана В.А.Кистяковскийдин изилдөөлөрүнө кыскача мүнөздөмө бергиле.
- Эмне үчүн электролиттердин эритмелери электро нейтралдуу?

































