Просмотр содержимого документа
«ЕГЭ по химии - задание 27»

ЕГЭ по химии задание 27

План
Расчеты объемных отношений газов при химических реакциях
Расчеты теплового эффекта реакции

Расчеты объемных отношений газов при химических реакциях
В основе этих вычислений лежат следствия из закона Авогадро. Согласно им отношения объёмов взаимодействующих между собой газов равно отношению коэффициентов перед формулами этих газов, записанных в уравнении, то есть объёмные соотношения реагентов и продуктов реакции соответствуют стехиометрическим соотношениям, отраженных в уравнении этой реакции.
Например, в реакци N 2 + 3H 2 = 2NH 3 , в объёмы всех записанных в уравнении в-в соотносятся как их стехиометрические коэффициенты:
V(N 2 ) : V(H 2 ): V(NH 3 ) = k(N 2 ) : k(H 2 ): k(NH 3 ) = 1 : 3 :2

Одним молем любого газообразного вещества в одинаковых условиях заполняется всегда один и тот же объём. Если 1 моль газа измерен при нормальных условиях (н.у.), то занимаемый им объём называется молярным объёмом . Он обозначается V m .
Это понятие позволяет вычислить количество газа:
n = V : Vm ,
здесь
n – кол-во газа,
V – его объём.
Исходя из этого V m = V : n , т.е. молярным объёмом определяется отношением объёма вещества к его количеству.
V m измеряется в л/моль и равен 22,4 л/моль.
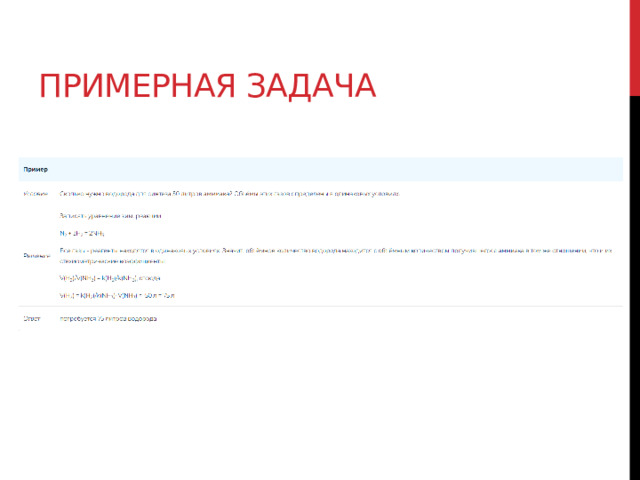
Примерная задача

Расчеты теплового эффекта реакции
Вычисления с определением теплового эффекта реакций
Общие понятия
Все химические реакции идут либо с выделением тепла – экзотермические реакции (+Q), либо с его поглощением – эндотермические реакции (-Q).
Величина теплоты, выделенной или поглощённой в ходе химического процесса – есть тепловой эффект реакции и обозначается Q.
Уравнения реакций с обозначенным тепловым эффектом Q называются термохимическими.
Примечание. В термохимических уравнениях обязательно указывается агрегатное состояние реагирующих веществ, влияющее на значение Q.

Примерная задача №1

Примерная задача №2

Задача для подготовки к егэ

Задача для подготовки к егэ

Домашняя работа
Вариант № 5511363
Ссылка - https:// chem-ege.sdamgia.ru/test?id=5511365


































